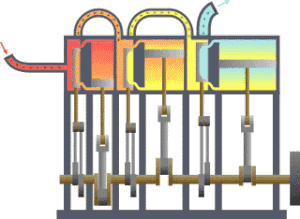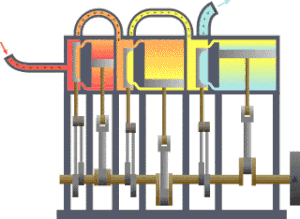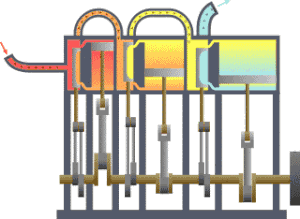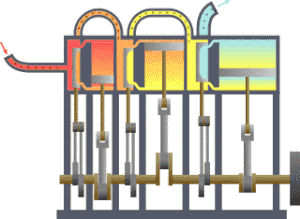
 熱力學 界
의 예. 熱傳達에 依해 피스톤 運動을 하는 機關.
熱力學 界
의 예. 熱傳達에 依해 피스톤 運動을 하는 機關.
熱力學
(熱力學,
thermodynamics
)은
에너지
,
熱
,
日
,
엔트로피
와 過程의 自發性을 다루는 物理學의 分野다.
統計 力學
과 密接한 關係를 가지며, 그로부터 수많은 熱力學 關係式을 誘導할 수 있다.
物質이나 에너지를 서로 交換하는 여러 物理系 사이의 熱力學的 過程을 다룰 때, 苦戰 熱力學은 그 過程이 完了되는 時間이나 그 過程이 얼마나 빨리 일어나는지에 對해서는 關心을 갖지 않는다. "熱力學"이라는 用語 代身
坪型 熱力學
이란 用語를 使用하며,
準靜的 過程
(quasi-static process)이라는 槪念이 매우 重要하다. 準靜的 過程은 "매우 천천히 變하여" 各 瞬間마다 "平衡狀態"로 看做할 수 있는 理想的인 過程을 말한다.
非平衡 熱力學
(non-equilibrium thermodynamics)에서 時間에 따라 變化하는 熱力學的 過程을 硏究한다.
熱力學 法則은 매우 一般的인 法則으로, 觀察하는 對象이나 物質 사이의 相互作用에 相關없이 恒常 成立하는 法則이다. 卽, 觀察하고자 하는 系와 이를 둘러싼 環境 사이에 에너지와 物質 交換이 平衡을 이룬다는 事實만 確認되면 恒常 適用할 수 있다. 이것에 對한 例로 20世紀 初
알베르트 아인슈타인
이 豫測한
自發 放出
(spontaneous emission)과 現在 硏究 中인
블랙홀 熱力學
이 있다.
熱力學의 歷史
[
編輯
]
熱力學의 歷史는 熱과 에너지에 關한 正義라 해도 無關하다. 1789年, 벤자민 럼포드에 依해 熱을 物質의 一種이라 看做했던 熱素理論이 깨지면서 熱力學의 歷史가 始作되었다. 1801年
존 돌턴
은 모든 氣體는 溫度의 增加에 따라 그 부피가 均一하게 增加한다는 事實을 發見했다. 1808年
게이뤼삭
은 모든 氣體의 부피가 0으로되는 溫度를 外삽에 依해 豫測할 수 있게 하였고, -273°C를
絶對溫度
0이라고 하였다. 1824年
니콜라 레오나르 사디 카르노
가 카르노 사이클을 만들었고, 1849年
켈빈 警
에 依해 妥當性이 立證되었다. 1850年 루돌프 클라우지우스는 熱力學 第 2法則을 定義했다. 또한 몇 달 뒤에 熱力學 第 1法則도 定義했다. 1873年 반데르발스가 狀態方程式을 考案했다. 1878年 조시아 깁스는 깁스에너지와 相律의 槪念을 導入했다. 1886年 라울은 프랑코 라울의 法則을 發表하였고, 1901年 길버트 루이스는 퓨개시티와 活動度의 槪念을 導入했다. 1949年 레들리히와 쾅은 狀態方程式을 實際氣體에 맞게 修正하였고, 1955年 케네스 피쳐는 非中心 人子의 槪念을 導入하였다. 흔히 여기까지의 歷史를
苦戰熱力學
의 範疇로 불린다.
熱力學 變數
[
編輯
]
一般的인 契의 形態나 契가 滿足해야 하는 條件에 따라 系의 狀態를 記述하기 위한 變數를 다르게 使用한다. 一般的으로 많이 使用하는 變數는 다음과 같다.
- 力學的 變數:
- 壓力
:

- 比부피
:
 (또는
부피
:
(또는
부피
:
 )
)
- 統計的 變數:
- 溫度
:

- 엔트로피
:

- 系를 構成하는 粒子의 數가 일정하지 않은
열린 界
(open system)에서는 다음과 같은 두 가지 變數를 더 생각한다.
- 系의 粒子 數

- 化學 퍼텐셜
(chemical potential)

위에 列擧된 易學的 變數들은 根本的인 古典 物理學 或은 兩者 物理學으로 記述할 수 있지만, 統計的인 變數는 오로지
統計 力學
으로만 理解할 수 있다. 熱力學이 適用되는 大部分의 境遇에, 하나 以上의 熱力學 變數는 變하지 않는 常數로 看做되고, 나머지 變數들만 變하게 된다. 數學的으로, 이것은 契의 狀態를
n
-次元 空間의 한 點으로 對應시켜 記述할 수 있다. 여기서 n은 상수가 아닌 變數의 個數이다.
統計 力學
을
古典 物理學
이나
兩者 物理學
과 結合하여, 이들 變數들 사이의 關係式을 나타내는
狀態 方程式
을 誘導할 수 있다. 가장 簡單하고 가장 重要한
狀態 方程式
은 바로
異常 氣體의 狀態 方程式
이다.

여기서
 은
氣體 常數
다. 或은 다음과 같이 記述하기도 한다.
은
氣體 常數
다. 或은 다음과 같이 記述하기도 한다.

여기서
 는
볼츠만 常數
로, 溫度와 에너지 사이의 關係를 나타내는 基本 物理 上手다. 氣體常數는 볼츠만 常數를
몰
로 나타낸 것이다.
는
볼츠만 常數
로, 溫度와 에너지 사이의 關係를 나타내는 基本 物理 上手다. 氣體常數는 볼츠만 常數를
몰
로 나타낸 것이다.
熱力學 퍼텐셜
[
編輯
]
物理系의 熱力學 變數는 다음과 같이 定義된 4가지
熱力學 퍼텐셜
로 定義할 수 있다.
- 內部 에너지
(internal energy)
E
: d
E
=
T
d
S
-
p
d
V
- 헬름홀츠 自由 에너지
A
: d
A
= ?
S
d
T
-
p
d
V
- 기브스 自由 에너지
G
: d
G
= ?
S
d
T
+
V
d
p
- 엔탈피
H
: d
H
=
T
d
S
+
V
d
p
위에 列擧된 熱力學 퍼텐셜들은 서로 無關한 量이 아니고 適切한 關係를 가지고 있다. 위의 熱力學 퍼텐셜의 美盆形을 合成函數의 微分을 使用하여
아래와 같은 關係式을 찾을 수 있다.




위에 列擧한 熱力學 퍼텐셜과 熱力學 變數 사이 關係式은 界에 相關없이 成立한다; 이 關係式은 契의 構成要素間 相互作用에 無關하게
統計 力學
으로부터 자연스럽게 얻을 수 있는 一般的인 關係式이다. 하지만 契의 構成要素 사이의 相互作用이나, 量子力學的인 에너지 準位와 에너지 準位의
縮退度
(degeneracy), 或은 系의
分配函數
를 모른다면, 위 네 가지 熱力學 퍼텐셜은 系의 熱力學 變數로만으로 完全히 表現할 수는 없다. 하지만 一旦 熱力學 퍼텐셜 中 하나가 熱力學 變數로 完全히 決定된다면, 나머지 세 熱力學 퍼텐셜은 위 關係式을 使用하여 쉽게 얻을 수 있다.
熱力學 界
[
編輯
]
熱力學 界
란 宇宙 全體 中에서 우리가 關心있는 一部를 말한다. 宇宙 全體 中에서 우리가 關心갖는 契를 除外한 나머지 宇宙를 흔히
環境
또는
熱源
라고 부른다. 環境과 界 사이에 實際 警戒 或은 假想敵인 境界가 存在하여 이 둘을 分離할 수 있다. 이 境界의 特性에 따라 環境과 界 사이에 에너지만 移動할 수도 있고, 物質이나 엔트로피도 移動할 수 있다. 따라서 이 境界의 特性에 따라 熱力學 界를 分類한다.
系와 環境 사이의 에너지, 物質, 엔트로피 交換形態에 따라 다음과 같이 熱力學 契를 3가지로 分類한다.
- 孤立系
: 環境과 열, 物質, 일 모두 交換하지 않는 系이다. 이 말은 數學的으로
 를 의미하며, 따라서
를 의미하며, 따라서
 를 의미한다. 孤立系의 例로, 外部와 完全히 隔離된 機體 실린더를 例를 들 수 있다.
를 의미한다. 孤立系의 例로, 外部와 完全히 隔離된 機體 실린더를 例를 들 수 있다.
- 닫힌系
(closed system): 環境과 에너지(熱과 일)는 交換하지만 物質은 交換하지 않는 契를 말한다. 一般的으로 닫힌系에서는 오직
 이다. 例를 들어, 溫室은 溫室 外部(環境)과 熱을 交換하지만 物質을 交換하지 않으므로 닫힌系로 看做할 수 있다. 契가 熱을 交換하든지 或은 일을 交換하든지 或은 둘 다 交換하든지, 이런 特性은 警戒의 性質로 理解하여 다음과 같은 境界를 定義한다.
이다. 例를 들어, 溫室은 溫室 外部(環境)과 熱을 交換하지만 物質을 交換하지 않으므로 닫힌系로 看做할 수 있다. 契가 熱을 交換하든지 或은 일을 交換하든지 或은 둘 다 交換하든지, 이런 特性은 警戒의 性質로 理解하여 다음과 같은 境界를 定義한다.
- 斷熱 警戒
(adiabatic boundary): 熱交換이 일어나지 않는다,

- 단단한 警戒
(rigid boundary): 日 交換이 일어나지 않는다,

- 열린 界
(open system)
: 에너지(熱과 일), 物質 모두 環境과 交換하는 契이다. 이런 境界는
透過性 있는
(permeable) 境界라 한다. 바다는 열린 系로 看做할 수 있다.
現實的으로 環境으로부터 完全히 分離된 嚴密한 孤立系는 存在할 수 없다. 왜냐하면 아무리 環境과 界 사이의 結合을 除去하더라도 重力은 除去할 수 없기 때문이다. 正常狀態의 契에서 빠져나가는 에너지와 들어오는 에너지는 같다.
[1]
Archived
2005年 6月 4日 -
웨이백 머신
주어진 一連의 條件 下에서 平衡狀態의 契는
定義된 狀態
(definite state)라고 한다. 契의 狀態는 여러
世紀 變數
(intensive variables)와
크기 變數
(extensive variables)로 記述된다. 系의 特性은 이 變數들 사이의 關係를 定해주는
狀態 方程式
(equation of state)로 記述된다.
熱力學 法則
[
編輯
]
熱力學에는 네 가지의 根本的인 法則이 있다. 이 社法則은 여러 가지의 서로 同等한 方法으로 記述할 수 있다.
熱力學 第 0 法則에 따르면, 萬若 界 A와 界 B가 接觸하여 熱力學的 平衡狀態를 이루고 있고 界 B와 界 C가 接觸하여 熱力學的 平衡狀態를 이루고 있다면, 界 A와 界 C가 接觸하여도 熱力學的 平衡을 이룬다. 두 契가 接觸하였을 때 熱力學的 平衡을 이루지 못한다면, 두 界 사이에 에너지나 物質의 알짜移動이 있다. 서로 熱力學的 平衡을 이루고 있는 두 契는 나중에 다시 接觸하였을 때도 平衡을 이룬다.
熱力學 第0法則은 熱力學의 根本的인 槪念이지만, 이것을 法則으로 陳述하게 된 것은 놀랍게도 熱力學의 많은 部分이 完成된 後인 1930年代이다. 이미 熱力學 1, 2, 3法則이 確立되었기 때문에, 熱力學의 가장 根本的인 이 槪念은 自然스럽게 0法則의 地位를 얻게 되었다. 如前히 熱力學 第0法則의 地位에 對한 論議가 이루어지고 있다.
[
出處 必要
]
熱力學的 平衡은
熱的 坪型
(熱交換과 溫度와 關係)과
力學的 坪型
(일交換과 壓力 같은 一般化된 힘과 關係)과
化學的 坪型
(物質交換과 化學퍼텐셜과 關係)을 包含한다.
要約: A와 B가 熱平衡을 이루고 있고, B와 C가 熱平衡을 이루고 있다면, A와 C도 서로 熱平衡을 이룬다.
熱力學 第 1 法則에 따르면,
斷熱 過程
에서 일交換은 過程(process)의 具體的인 形態에 相關없이 初期 狀態와 最終 狀態에만 關係한다. 斷熱過程에서는 熱移動이 없기 때문에, 이것은
에너지 保存 法則
과 同等한 陳述이다. 이 法則은 斷熱過程下에서 系의 에너지 이동은 契가 한 일 或은 契에 한 일밖에 없음을 의미한다.
이는 數學的으로 다음과 같이 表現된다.

여기서 U는 系의 內部 에너지, q는 系로 흘러들어간 열에너지, w는 契가 한 일이다.
高溫의 열貯藏庫와 低溫의 열貯藏庫를 物體로 連結해놓으면 高溫의 열貯藏庫에서 열에너지가 低溫의 열貯藏庫로 傳導된다. 이러한 傳達되는 열에너지를 單位時間當 傳達되는 比率을 傳導率이라고 한다. 連結된 物體의 面積을 A, 길이를 L이라고 하면
傳導率 P = kA(Th-Tc)/L로 나타낼 수 있다(k=열전도도, Th=高溫의 열貯藏庫의 溫度, Tc=低溫의 열貯藏庫의 溫度).
熱傳導度 k는 物體의 固有한 特徵으로 常數값을 지닌다. 열에너지를 빨리 傳達하는 物質일수록 좋은 列傳導體로서 k값이 크다.
要約: 孤立系의 에너지總合은 一定하다
熱力學 第2法則에 따르면, "熱源(reservoir)으로부터 量의 열에너지를 뽑아서 모두 일로 轉換하되, 다른 追加的인 效果를 同伴하지 않는 循環過程(cycle)은 存在하지 않는다."(
Kelvin
-
Planck
陳述) 다시 말해, 熱的으로 孤立된 거時計의
엔트로피
는 絶對 減少하지 않는다(
맥스웰의 도깨비
參考). 하지만 美時計에서는 第2法則이 陳述하는 것과 反對로 行動하는 엔트로피의
搖動
(fluctuation)이 있다(
搖動 整理
(Fluctuation Theorem)). 事實, 可逆 動力學(time-reversible dynamics)와 因果律의 公理(Axiom of Causality)로부터 요동 整理를 數學的으로 證明할 수 있고, 이것이 第2法則의 證明이 되겠다. 論理的으로 제2법칙은 物理學의 "法則"이라기 보다, 매우 큰 界 或은 오랜 時間에 對한 整理일 뿐이다.
要約: 孤立系에서의 엔트로피는 絶對 減少하지 않는다.
熱力學 第3法則은 統計學上으로 나타나는 自然的인 法則이며, 絶對零度에 다다르는 것의 不可能에 對하여 다룬다. 이 法則은 엔트로피의 값의 決定에 基準點(絶對零度)을 提供해 주는데, 이처럼 絶對零度를 基準으로 하여 相對的으로 決定된 엔트로피를 絶對 엔트로피라고 한다.
엔트로피는 絶對零度에 가까워질수록 변화량이 0에 收斂하며, 絶對零度에서 完全한 決定狀態의 엔트로피는 0이다. 다만 自然系에서 絶對零度는 存在할 수 없고 但只 0으로 收斂할 뿐이다.
'어떠한 界, 或은 系의 어떠한 狀態에서든지, 엔트로피는 絶對零度에서 最小이다'라고 表現할 수도 있으며, '有限番의 過程을 통해 絶對零度에 到達하는 것은 不可能하다'라는 表現도 使用할 수 있다.
要約: 自然系에서 絶對零度는 存在하지 않는다.
熱力學 法則과 力學
[
編輯
]
熱力學 第1法則은 古典力學 或은 量子力學의 法則만으로 嚴密하게 얻어진다.
搖動 整理
(fluctuation theorem)로부터 熱力學 第2法則을 力學法則으로부터 誘導할 수 있으나. 거時計나 時間을 無限大로 보내는 極限에서만 成立한다.
예제
[
編輯
]
카르노 機關
[
編輯
]
機關이란 열貯藏庫에서 熱을 뽑아 일을 遂行하는 裝置다. 機關의 效率은
熱效率
로 나타낸다. 熱效率은 供給된 열에너지에 對한 일의 比率 (卽 使用한 에너지/얻은 에너지)로 定義한다 熱效率이 摩擦이나 막흐름 等에 依한 에너지 損失이 하나도 없이 最大가 되는 機關을
카르노 機關
이라고 한다. 一般的으로
- 熱效率 = W(일)/얻은 열에너지(Qh) = 1 - Ql(放出한 열에너지)/Qh
인데, 카르노 機關에서는
- 熱效率 = 1 - Tl(低溫의 열貯藏庫의 溫度)/Th(高溫의 열貯藏庫의 溫度)
이다. Tl<Th이므로, 카르노 機關의 效率은 100%보다는 낮음을 알 수 있다. 卽, 效率이 100%인 假想의
永久機關
은 熱力學 第2法則을 違背하여 實在할 수 없다.
溫度만으로 記述되는 界
[
編輯
]
黑體 複寫
問題는
光子
의 個數가 保存되지 않기 때문에 代表的인 예제가 될 수 있다. 이렇게 粒子數가 保存되지 않는 契는
上典이
나
自發對稱破壞
가 일어나지 않는다면,
溫度
滿으로 完全히 決定된다. 上典이나 自發對稱破壞가 일어난다면,
上
을 區別하기 위해 다른 物理量이 必要하다. (多幸히도 黑體 複寫 問題에서는 이런 일은 이러나지 않는다.) 內部 에너지가 溫度만의 函數이므로,
헬름홀츠 自由 에너지
F = U - TS
를 定義해서 使用할 수 있다.
溫度와 壓力만으로 記述되는 界
[
編輯
]
大部分의 "純粹한" 非磁性物質은 이 範疇에 屬한다. 이러한 契의 狀態는 整列된 上(ordered phase)에서 上典이나 自發的인 對稱性 破壞가 없다면 溫度와 壓力만으로 完全히 記述할 수 있다.
U
와
V
(或은 密度 ρ)가
T
와
P
의 函數로 주어진다면, 우리는
헬름홀츠 自由 에너지
F = U - TS
와
기브스 自由 에너지
G = U - TS + PV
와 엔탈피
H = U + PV
를 定義할 수 있다.
溫度와 壓力, 化學 퍼텐셜으로 記述되는 界
[
編輯
]
原子/分子가 한 種類 以上 있다면, 이 範疇에 屬한다. 이러한 契의 狀態는
溫度
와 壓力, 化學 퍼텐셜로 記述할 수 있다. 여기서도 整列된 相議 上典이나 自發的인 對稱 破壞가 없을 때만 3가지 量으로 記述할 수 있다.
溫度와 磁氣場으로 記述되는 界
[
編輯
]
다루고자 하는 物質이
强磁性
이나
超傳導性
을 띠면, 이 範疇에 屬한다. 이러한 契는 溫度와 磁氣場만으로 完全히 記述된다. 이 境遇도 上典이나 自發的인 對稱 破壞가 없을 때이다.
같이 보기
[
編輯
]
外部 링크
[
編輯
]
|
|---|
| 基本 槪念
| |
|---|
| 技術
| |
|---|
| 構成 要素
| |
|---|
測定
및 制御
| |
|---|
職業, 貿易,
서비스
| |
|---|
| 産業 團體
| |
|---|
| 健康 및 安全
| |
|---|