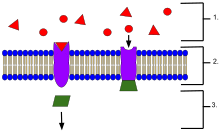
 막 受容體의 예
막 受容體의 예
- 細胞 外部에 位置한 리간드
- 리간드는 蛋白質의 活性 部位의 模樣에 따라 特定 受容體 蛋白質에 結合한다.
- 리간드가 受容體에 結合하면 受容體는 傳達者를 放出한다.
受容體
(受容體,
英語
:
receptor
)는
生化學
및
藥理學
에서 生物學的 시스템에 統合될 수 있는 信號를 受信하고
傳達
하는
蛋白質
로 構成된 化學的 構造이다.
[1]
이러한 信號는 一般的으로 受容體와 結合하여
細胞의 電氣的 活性
의 變化와 같은
生理學的 反應
을 生成하는 化學的 傳達者이다.
[週 1]
例를 들어, 抑制性
神經傳達物質
人
GABA
는
GABA
A
受容體
와 結合하여 뉴런의 電氣的 活性을 抑制한다.
[2]
受容體의 作用은 信號의 中繼, 增幅, 統合이라는 세 가지 主要 方法으로 分類될 수 있다.
[3]
中繼는 信號를 앞으로 내보내고, 增幅은 單一
리간드
의 效果를 증가시키며, 統合을 위해 信號가 다른 生化學的 經路에 統合될 수 있다.
[3]
受容體 蛋白質은 位置에 따라 分類할 수 있다. 幕貫通 受容體라고도 알려진
細胞 表面 受容體
에는
리간드 改廢 이온 通路
,
G 蛋白質 連結 受容體
,
酵素 連結 受容體
가 있다.
[1]
細胞內 受容體
는 細胞 內部에서 發見되는 受容體로, 細胞質 受容體와
核 受容體
가 있다.
[1]
受容體에 結合하는 分子를
리간드
라고 하며
蛋白質
,
펩타이드
(길이가 짧은 蛋白質) 또는
神經傳達物質
,
호르몬
,
醫藥品
,
毒素
,
칼슘 이온
, 바이러스나 微生物 外部의 一部와 같은 다른
低分子
일 수 있다. 特定 受容體에 結合하는 內因性 生成 物質을 內因性 리간드라고 한다. 例를 들어,
니코틴性 아세틸콜린 受容體
에 對한 內因性 리간드는
아세틸콜린
이지만, 이는
니코틴
에 依해 活性化되고
[4]
[5]
큐라레
의 依해 遮斷될 수도 있다.
[6]
特定 類型의 受容體는 信號에 該當하는 特定 生化學的 經路에 連結된다. 大部分의 細胞에는 수많은 受容體가 發見되지만 各 受容體는 特定 構造의 리간드에만 結合한다. 이는
酵素
에서의
자물쇠-열쇠 모델
과 類似하게 比較되었다. 리간드가 該當 受容體에 結合하면 受容體와 곤聯된 生化學的 經路(또한 高度로 專門化될 수 있음)를 活性化하거나 抑制한다.
受容體 蛋白質은 리간드의 特性에 따라 分類할 수도 있다. 이러한 分類에는
化學受容體
,
機械受容體
,
重力受容體
, 光受容體, 自己受容體, 機體受容體가 包含된다.
救助
[
編輯
]
 幕貫通 受容體: E=細胞 外 空間, I=細胞 내 空間, P=原形質膜
幕貫通 受容體: E=細胞 外 空間, I=細胞 내 空間, P=原形質膜
受容體의 構造는 매우 다양하며, 特히 다음과 같은 主要 部類로 나눌 수 있다.
- 類型 1:
리간드 改廢 이온 通路
(이온性 受容體) ? 리간드 改廢 이온 通路는 一般的으로
아세틸콜린
(니코틴性) 및
γ-아미노뷰티르山
(GABA)과 같은 傳達 速度가 빠른
神經傳達物質
의 標的이다. 이들 受容體의 活性化는 膜을 가로지르는 이온 移動의 變化를 招來한다. 이들은 各 小單位體가 細胞外 리간드 結合 도메인과 4個의 幕貫通
α-나선
을 包含하는 幕貫通 도메인으로 構成된다는 點에서 헤테로머(heteromer) 構造를 가지고 있다. 리간드 結合 共同(cavity)은 小段位體 사이의 境界面에 位置한다.
- 類型 2:
G 蛋白質 連結 受容體
(大司成 受容體) ? G 蛋白質 連結 受容體는 受容體의 가장 큰 패밀리이며, 여러 호르몬과 傳達 速度가 느린 神經傳達物質(예: 도파민, 大司成 글루탐산)의 標的이다. G 蛋白質 連結 受容體는 7個의 幕貫通 α 螺旋으로 構成된다. α 螺旋을 連結하는 루프는 細胞外 도메인과 細胞內 도메인을 形成한다. 더 큰 펩타이드 리간드의 結合 部位는 一般的으로 細胞外 도메인에 位置하는 反面, 더 작은 비펩타이드 리간드의 結合 部位는 普通 7個의 α 나선과 1個의 細胞外 루프 사이에 位置한다.
[7]
앞서 言及한 受容體는
G 蛋白質
을 통해 다양한 細胞內 效果器 시스템에 連結된다.
[8]
G 蛋白質은 α, β, γ의 3가지 小單位體로 構成된 이종삼輛體이다. 非活性 狀態에서 3가지 小單位體는 함께 結合해 있고 α 小單位體는 GDP와 結合해 있다.
[9]
G 蛋白質의 活性化는 立體構造的 變化를 일으키고, 이는 GDP를 GTP로 交換되도록 한다. α 小單位體가 GTP와 結合하면 α 小單位體는 β 小單位體와 γ 小單位體와 分離된다.
[10]
또한, 3가지 小段位체인 α, β, γ 小單位體는 1次 序列에 따라 4가지 主要 部類로 追加的으로 나눌 수 있다. 여기에는 G
s
, G
i
, G
q
, G
12
가 包含된다.
[11]
- 類型 3:
酵素 連結 受容體
(
受容體 티로신 키네이스
및 키네이스 連結 受容體 및 키네이스 關聯 受容體를 參照) ? 酵素 連結 受容體는 리간드 結合 部位를 包含하는 細胞外 도메인과 單一 幕貫通 α 螺旋으로 連結된 種種 酵素 機能을 갖는 細胞內 도메인으로 構成된다. 例로는
인슐린 受容體
가 있다.
- 類型 4:
核 受容體
? 核 受容體라고 불리지만 이들은 實際로는
細胞質
에 位置하며 리간드와 結合한 後
核
으로 移動한다. 核 受容體는
C-末端
리간드 結合 領域, 核心
DNA 結合 도메인
, AF1(活性化 機能 1) 領域을 包含하는
N-末端
도메인으로 構成된다. 核心 領域에는 이 受容體에 特定한 DNA 序列을 認識하는 役割을 하는 두 個의 亞鉛 핑거가 있다. N-末端은 리간드 非依存的 方式으로 다른 細胞의 戰士因子와 相互作用을 한다. 그리고 이러한 相互作用에 따라 受容體의 結合/活性을 變形할 수 있다. 스테로이드 호르몬 受容體와 갑상샘 호르몬 受容體가 그러한 受容體의 例이다.
[12]
막 受容體는
溶媒
,
界面活性劑
및
親和性 精製
를 使用하는 複雜한 抽出 節次를 통해 細胞膜으로부터 分離될 수 있다.
受容體의 構造와 作用은
X線 結晶學
,
核磁氣 共鳴
(NMR),
圓偏光 二色性
,
二重 偏頗 干涉法
과 같은
生物物理學的
方法을 使用하여 硏究할 수 있다. 受容體의 動的 行動에 對한
컴퓨터 시뮬레이션
을 使用하여 受容體의 作用 메커니즘을 理解할 수 있게 되었다.
結合 및 活性化
[
編輯
]
리간드의 結合은
化學 平衡
過程이다. 리간드는 리간드 L과 受容體 R에 對해 다음의 方程式에서
質量作用의 法則
에 따라 受容體에 結合하고 分離된다. 化學種에 標示된 大括弧는 該當 化學種의 濃度를 나타낸다.
![{\displaystyle {[{\ce {L}}]+[{\ce {R}}]{\ce {<=>[{K_{d}}]}}[{\text{LR}}]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8bc59879baab1d42236bb74c50da94e2ceef5afd)
리간드가 受容體에 얼마나 잘 들어맞는지를 測定하는 한 가지 方法은 結合 親和度를 測定하는 것이며, 이는
解離 常數
K
d
에 反比例한다. 리간드가 높은 親和力과 낮은 K
d
값을 가질수록 受容體에 더 잘 結合한다. 最終的인 生物學的 反應(예:
2次 傳達者 캐스케이드
, 筋肉 收縮)은 相當한 數의 受容體가 活性化된 後에만 達成된다.
親和度(affinity)는 리간드가 受容體에 結合하는 傾向을 測定한 것이다.
效能
(efficacy)은 受容體를 活性化하기 위해 結合된 리간드를 測定하는 것이다.
作用劑 및 拮抗劑
[
編輯
]
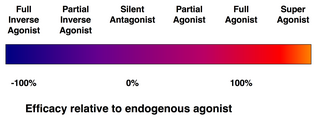 受容體 리간드의 效能 스펙트럼
受容體 리간드의 效能 스펙트럼
受容體에 結合하는 모든 리간드가 該當 受容體를 活性化시키는 것은 아니다. 다음과 같은 種類의 리간드가 存在한다.
- (完全)
作用劑
는 受容體를 活性化시켜 强力한 生物學的 反應을 일으킬 수 있다. 주어진 受容體에 對해 가장 큰
效能
을 갖는 天然
內因性
리간드는 定義에 따라 完全 作用劑(100% 效能)이다.
- 部分 作用劑
는 最大 結合을 하더라도 最大 效能으로 受容體를 活性化시키지 않아 完全 作用劑에 비해 部分的인 反應을 誘發한다(효능 0~100%).
- 拮抗劑
는 受容體에 結合하지만 受容體를 活性化시키지 않는다. 이는 受容體 遮斷을 招來하여 作用劑와 逆作用制의 結合을 抑制한다. 受容體 拮抗劑는 競爭的(또는 可逆的)일 수 있으며 受容體에 對한 作用劑와 競爭할 수도 있고, 受容體와
共有 結合
(또는 매우 높은 親和力의 非共有 結合)을 形成하여 이를 完全히 遮斷하는 非可逆的 拮抗劑日 수도 있다. 陽性子 펌프 沮害劑인
오메프라졸
은 非可逆的 拮抗劑의 例이다. 非可逆的 拮抗作用의 效果는 새로운 受容體의 合成에 依해서만 되돌릴 수 있다.
- 逆作用第
는 構成的 活性을 沮害하여 受容體의 活性을 감소시킨다(음성 效能).
- 알로스테릭 調節因子
는 受容體의 作用劑 結合 部位에 結合하지 않고 代身 特定 알로스테릭 結合 部位에 結合하여 作用劑의 效果를 變形시킨다. 例를 들어,
벤조다이아제핀
(BZD)은
GABA
A
受容體
의 BZD 部位에 結合하여 內因性 GABA의 效果를 强化한다.
受容體 作用과 拮抗作用의 槪念은 受容體와 리간드 사이의 相互作用만을 의미하며 生物學的 效果를 의미하지 않는다는 點에 留意해야 한다.
構成的 活性
[
編輯
]
리간드의 結合이 없이도 生物學的 反應을 生成할 수 있는 受容體는 "構成的 活性"을 나타낸다고 한다.
[13]
受容體의 構成的 活性은
逆作用第
에 依해 遮斷될 수 있다.
項肥滿第
人
리모나반트
와
타라나반트
는
칸나비盧이드 受容體 1
(CB1)의 逆作用制이며 相當한 體重 減少를 가져왔지만 憂鬱症과 不安의 높은 發生率로 인해 둘 다 使用이 中斷되었다. 이는 칸나비盧이드 受容體의 構成的 活性 沮害와 關聯이 있는 것으로 여겨진다.
GABA
A
受容體
는 構成的 活性을 가지며 作用제가 없을 때 一部 基本的인 흐름을 處理한다. 이를 通해
β-카르볼린
은 逆作用제로 作用하여 흐름을 基本 水準 以下로 減少시킬 수 있다.
構成的 活性을 증가시키는 受容體의 突然變異는
性早熟症
(黃體形成 호르몬 受容體의 突然變異로 因해) 및
갑상샘 機能 亢進症
(갑상샘 刺戟 호르몬(TSH) 受容體의 突然變異로 因해)과 같은 一部 遺傳 疾患의 原因이 된다.
藥物-受容體 相互作用의 理論
[
編輯
]
占有
[
編輯
]
藥理學
에서
受容體 理論
의 初期 形態는 藥물의 效果가 占有된 受容體의 數에 正比例한다고 明示했다.
[14]
더욱이, 藥物-受容體 複合體가 해리됨에 따라 藥物 效果가 中斷된다.
아리엔스
와 스티븐슨(Stephenson)은 受容體에 結合된 리간드의 作用을 說明하기 위해 親和度(affinity) 및 效能(efficacy)이라는 用語를 導入했다.
[15]
[16]
- 親和度
: 藥物-受容體 複合體를 生成하기 위해 受容體와 結合하는 藥物의 能力이다.
- 效能
: 藥物-受容體 複合體가 形成된 後 反應을 開始하는 藥物의 能力이다.
速度
[
編輯
]
收容된 占有 理論과 對照的으로 速度 理論은 受容體의 活性化가 單位 時間 黨 藥물과 受容體의 總 接觸 回數에 正比例한다고 提案한다. 藥理學的 活性은 占有된 受容體의 數가 아니라 解離 및 結合 速度에 正比例한다.
[17]
- 作用劑: 빠른 結合과 빠른 해리를 보이는 藥물이다.
- 部分 作用劑: 中間的인 速度의 結合과 中間的인 速度의 해리를 보이는 藥물이다.
- 拮抗劑: 빠른 結合과 느린 해리를 보이는 藥물이다.
誘導 適合
[
編輯
]
藥물이 受容體에 結合하면 受容體의 結合 部位의 立體構造가 變化하여 藥物-受容體 複合體가 生成된다.
豫備 受容體
[
編輯
]
一部 受容體 시스템(예:
平滑筋
의
神經筋 接合符
에 있는
아세틸콜린
)에서 作用劑는 매우 낮은 水準의 受容體 占有率(<1%)에서 最大 反應을 誘導할 수 있다. 따라서 該當 시스템에는 豫備 受容體가 있다. 이러한 配列은 神經傳達物質의 生成 및 放出의 經濟性을 創出한다.
[12]
受容體 調節
[
編輯
]
細胞는 特定
호르몬
이나
神經傳達物質
에 對한 受容體의 數를 늘리거나(
上向調節
) 減少시켜(
下向調節
) 다른 分子에 對한 敏感度를 變更할 수 있다. 이는 局地的으로 作動하는
피드백
메커니즘이다.
例示 및 리간드
[
編輯
]
受容體에 對한 리간드는 受容體만큼 다양하다. G 蛋白質 連結 受容體는 特히 構成員이 810個 以上인 大規模 패밀리이다. 또한 적어도 12가지의 內因性 리간드에 對한
리간드 改廢 이온 通路
가 있으며, 다양한 小段位體 構成을 통해 더 많은 種類의 受容體가 可能하다. 리간드 및 受容體의 一般的인 例는 다음과 같다.
[19]
이온 通路 連結 受容體
[
編輯
]
이온性 受容體
(
리간드 改廢 이온 通路
)의 몇 가지 例가 아래의 表에 나타나 있다. 主要 神經傳達物質은 글루탐산과 GABA이다. 다른 神經傳達物質은
神經調節性
이다. 이 目錄은 決코 完全한 것이 아니다.
G 蛋白質 連結 受容體
[
編輯
]
大司成 受容體
(特히,
G 蛋白質 連結 受容體
)의 몇 가지 例가 아래의 表에 나타나 있다. 主要 神經傳達物質은 글루탐산과 GABA이다. 다른 神經傳達物質은 神經調節性이다. 이 目錄은 決코 完全한 것이 아니다.
酵素 連結 受容體
[
編輯
]
酵素 連結 受容體
에는
受容體 티로신 키네이스
(RTK), 細鱗/트레오닌 特異的 蛋白質 키네이스(뼈形成 蛋白質의 境遇),
구아닐산 고리化酵素
(心房 나트륨이뇨 人者 受容體의 境遇)가 包含된다. 受容體 티로신 키네이스(RTK) 中 20個의 部類가 識別되었으며, 58個의 서로 다른 RTK가 構成員으로 包含된다. 몇 가지 例가 다음과 같이 아래에 標示되어 있다.
細胞內 受容體
[
編輯
]
受容體는 메커니즘이나 細胞 內 位置에 따라 分類할 수 있다. 細胞內 리간드 改廢 이온 通路(LGIC)의 4가지 例는 다음과 같다.
健康 및 疾病에서의 役割
[
編輯
]
遺傳 疾患에서
[
編輯
]
많은
遺傳 疾患
은 受容體 遺傳子의 遺傳的 缺陷과 關聯이 있다. 種種 受容體가 기능하지 않는지 또는
호르몬
이 減少된 水準으로 生成되는지 判斷하기가 어렵다. 이로 因해
內分泌 障礙
의 "假想 低下" 그룹이 發生하는데, 여기서는 호르몬 數値가 減少한 것처럼 보이지만 實際로는 호르몬에 充分히 反應하지 않는 受容體로 인한 것이다.
免疫界에서
[
編輯
]
免疫界
에서의 主要 受容體로는
패턴 認識 受容體
(PRR),
톨 類似 受容體
(TLR),
自然殺害細胞 活性化 受容體
(KAR),
自然殺害細胞 免疫글로불린 類似 受容體
(KIR),
補體 受容體
,
Fc 受容體
,
B 細胞 受容體
,
T 細胞 受容體
가 있다.
[20]
같이 보기
[
編輯
]
註解
[
編輯
]
- ↑
로돕신
受容體의 境遇 入力 對象은 化學 物質이 아닌
光子
이다.
- ↑
서로 다른 리간드 改廢 이온 通路는 서로 다른
이온
乙 이동시킨다. 이는
K
+
이온 通路
의 選擇性 필터와 같은 選擇性 필터를 使用하여 遂行된다.
各州
[
編輯
]
- ↑
가
나
다
Guyton, Arthur C.; Hall, John E. (2016).
《Guyton and Hall Textbook of Medical Physiology》
. Philadelphia, PA: Elsevier Saunders. 930?937쪽.
ISBN
9781455770052
.
OCLC
1027900365
.
- ↑
Mihic, S. John; Harris, R. Adron (1997).
“GABA and the GABA
A
Receptor”
. 《Alcohol Health and Research World》
21
(2): 127?131.
ISSN
0090-838X
.
PMC
6826832
.
PMID
15704348
.
- ↑
가
나
Alberts, Bruce; Bray, Dennis; Hopkin, Karen; Johnson, Alexander; Lewis, Julian; Raff, Martin; Roberts, Keith; Walter, Peter (2014). 《Essential Cell Biology》 Four版. New York, NY, USA: Garland Science. 534쪽.
ISBN
978-0-8153-4454-4
.
- ↑
Gotti, Cecilia; Marks, Michael. J.; Millar, Neil S.; Wonnacott, Susan (2019年 9月 16日).
“Nicotinic acetylcholine receptors (version 2019.4)”
. 《IUPHAR/BPS Guide to Pharmacology CITE》
2019
(4).
doi
:
10.2218/gtopdb/F76/2019.4
. 2020年 11月 17日에 確認함
.
- ↑
Malenka RC, Nestler EJ, Hyman SE (2009). 〈Chapter 9: Autonomic Nervous System〉. Sydor A, Brown RY. 《Molecular Neuropharmacology: A Foundation for Clinical Neuroscience》 2板. New York: McGraw-Hill Medical. 234쪽.
ISBN
9780071481274
.
Nicotine ... is a natural alkaloid of the tobacco plant. Lobeline is a natural alkaloid of Indian tobacco. Both drugs are agonists [of] nicotinic cholinergic receptors ...
- ↑
“Curare Drug Information, Professional”
. 《Drugs.com》 (英語). 2018年 11月 16日에
原本 文書
에서 保存된 文書
. 2020年 12月 8日에 確認함
.
- ↑
Congreve M, Marshall F (March 2010).
“The impact of GPCR structures on pharmacology and structure-based drug design”
. 《British Journal of Pharmacology》
159
(5): 986?96.
doi
:
10.1111/j.1476-5381.2009.00476.x
.
PMC
2839258
.
PMID
19912230
.
- ↑
Qin K, Dong C, Wu G, Lambert NA (August 2011).
“Inactive-state preassembly of G(q)-coupled receptors and G(q) heterotrimers”
. 《Nature Chemical Biology》
7
(10): 740?7.
doi
:
10.1038/nchembio.642
.
PMC
3177959
.
PMID
21873996
.
- ↑
Zubay, Geoffrey (1998). 《Biochemistry 4th Ed.》. Dubuque, IA: William C Brown Pub. 684쪽.
ISBN
0697219003
.
- ↑
Garrett, Reginald; Grisham, Charles (2012). 《Biochemistry》. Cengage Learning. 1130쪽.
ISBN
9781473733602
.
- ↑
Hamm, Heidi E.; Oldham, William M. (2008). “Heterotrimeric G Protein Activation by G-Protein-Coupled Receptors”. 《Nature Reviews Molecular Cell Biology》 (Nature Publishing Group)
9
(1): 60?71.
doi
:
10.1038/nrm2299
.
PMID
18043707
.
S2CID
24267759
.
- ↑
가
나
Rang HP, Dale MM, Ritter JM, Flower RJ, Henderson G (2012). 《Rang & Dale's Pharmacology》 7板. Elsevier Churchill Livingstone.
ISBN
978-0-7020-3471-8
.
- ↑
Milligan G (December 2003). “Constitutive activity and inverse agonists of G protein-coupled receptors: a current perspective”. 《Molecular Pharmacology》
64
(6): 1271?6.
doi
:
10.1124/mol.64.6.1271
.
PMID
14645655
.
S2CID
2454589
.
- ↑
Rang, HP (January 2006).
“The receptor concept: pharmacology's big idea”
. 《British Journal of Pharmacology》
147
(Suppl 1): S9?16.
doi
:
10.1038/sj.bjp.0706457
.
PMC
1760743
.
PMID
16402126
.
- ↑
Ariens EJ (September 1954). “Affinity and intrinsic activity in the theory of competitive inhibition. I. Problems and theory”. 《Archives Internationales de Pharmacodynamie et de Therapie》
99
(1): 32?49.
PMID
13229418
.
- ↑
Stephenson RP (December 1956).
“A modification of receptor theory”
. 《British Journal of Pharmacology and Chemotherapy》
11
(4): 379?93.
doi
:
10.1111/j.1476-5381.1956.tb00006.x
.
PMC
1510558
.
PMID
13383117
.
- ↑
Silverman RB (2004).
〈3.2.C Theories for Drug?Receptor Interactions〉
.
《The Organic Chemistry of Drug Design and Drug Action》
2板. Amsterdam: Elsevier Academic Press.
ISBN
0-12-643732-7
.
- ↑
Boulay G, Chretien L, Richard DE, Guillemette G (November 1994). “Short-term desensitization of the angiotensin II receptor of bovinde adrenal glomerulosa cells corresponds to a shift from a high to low affinity state”. 《Endocrinology》
135
(5): 2130?6.
doi
:
10.1210/en.135.5.2130
.
PMID
7956936
.
- ↑
가
나
다
라
마
바
社
아
者
次
카
타
Boulpaep EL, Boron WF (2005). 《Medical Physiology: A Cellular and Molecular Approach》. St. Louis, Mo: Elsevier Saunders. 90쪽.
ISBN
1-4160-2328-3
.
- ↑
Waltenbaugh C, Doan T, Melvold R, Viselli S (2008).
《Immunology》
. Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins.
20
쪽.
ISBN
978-0-7817-9543-2
.
外部 링크
[
編輯
]