 [그림 1] GPCR의 救助
[그림 1] GPCR의 救助
G 蛋白質 連結 受容體
(G protein coupled receptor,
GPCR
)는
7-幕貫通 受容體
(7-Transmembrane receptor,
7TMR
)라고도 불린다. 이름에서 알 수 있듯이 [그림 1]에서 살펴보면 이것의 救助는 細胞膜 或은 細胞 內의 機關의
細胞膜
에서 細胞質 面과 細胞 外面에 걸쳐있고 막을 7番 通過하는 構造이다. 生體內에서 800~1000個 程度의
受容體
의 種類가 存在 하고, 事實上 生體內의 거의 모든 生理的 反應을 觸媒한다 이것의 種類는 크게 5 가지로 나뉘며 (type A, B, C, D, E, F), type A에는 빛을 感知하는
로돕신
, 냄새를 感知하는 後感覺 受容體,
아드레날린
或은
노르아드레날린
을 感知하는
아드레날린 受容體
가 있다. Type B에는
펩티드 受容體
가 存在하며, Type C에는 글壘打메이트 受容體 그리고 美感覺 受容體가 存在한다고 알려져 있다. 이때 受容體에 붙는 物質을
리간드
라고 定義하며 리간드는 受容體의 反應을 促進하는
受容體 作用劑
와 反應을 促進하지 않는
受容體 對抗第
로 나뉘게 된다.
信號傳達
[
編輯
]
 [그림 2]Classical signal of GPCR
[그림 2]Classical signal of GPCR
G-蛋白質 媒介 信號 傳達
[
編輯
]
GPCR의 信號傳達體系는 數 十年 동안 많은 硏究의 結果로 一般的으로 밝혀져 있다. [그림 2]에서 그러한 傳達體系를 簡略히 紹介하고자 한다. 리간드 或은 受容體 作用제가 受容體에 結合 하게 되면 受容體는 構造가 바뀌게 된다. 構造가 바뀐 受容體는 G-蛋白質과 連結되고 이러한 接觸에 依해 G-蛋白質은 Gα 와 Gβ-Gγ 二重體 構造로 나뉜다. 各其 나뉜 物質은 細胞 或은 器官內의 2次 메신저의 反應을 觸媒하고 그러한 連鎖的인 反應에 依해 다양한 細胞 反應이 일어나게 된다.
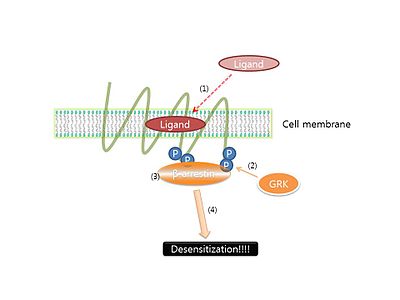 [그림 3] β-arrestin에 依한 Desensitization
[그림 3] β-arrestin에 依한 Desensitization
β-어레스틴(arrestin) 媒介 信號 傳達
[
編輯
]
그러나 거의 모든 GPCR 反應에서는 리간드가 反應을 持續的으로 하게 되어 일정한 時間이 지나게 되면 反應의 結果物이 오히려 줄어든다는 結論이 많은 論文에서 밝혀졌다. 이것을 細胞內 一種의 恒常性을 維持하기 위한 期作으로서, GPCR의 境遇 이것을
Desensitization
이라 불린다. 이러한 Desensitization은 GPCR이 蛋白質 키나아제
protein kinase GRK
에 依해 燐酸化되어 일어난다고 알려져있다. 인산화된 GPCR은 β-arrestin과 結合하게 되고, 結合된
β-arrestin
이 GPCR이 G-蛋白質과 接觸하는 것을 妨害하여 信號傳達이 일어나지 않게 되는 것이다. 그렇기에 β-arrestin에 依한 새로운 信號傳達體系는 다음 [그림 3]과 같다. β-arrestin은 desensitization 信號傳達體系外에
食作用
(或은 internalization)과 그것 自體의 信號傳達體系가 있다고 많은 論文에서 밝혀졌다. 簡略히 살펴보면 食作用이 일어나는 期作은 먼저 受容體에 結合된 β-arrestin이 劉備퀴티네이트가 되고 그 後에 β-arrestin에 GO 蛋白質과 같은 重妹弟가 結合하게 된다. 結合한 GO 蛋白質은 여러 모터蛋白質과 接觸하게 되어 리간드, 受容體, 幕의 凝集을 促進한다. 이런 期作으로 形成된 버블은 細胞內 受容體 或은 리간드가 必要한 곳으로 移動하거나 리소좀에 依해 分解된다. 그리고 β-arrestin의 信號傳達體系는 最近에 많은 論文에서 밝혀졌지만 아직까지 많은 期作이 밝혀지지 않았기에 硏究가 現在進行形이라고 알려져 있다.
G-蛋白質의 構造
[
編輯
]
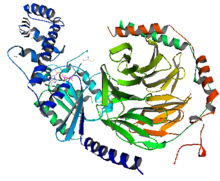 [그림 4] G-protein 救助
[그림 4] G-protein 救助
 [그림 5] DXMS分析을 利用한 solution에서 Gα의 構造的인 變化(α5와β1만 比較), HX: The changes in amide hydrogen?deuterium exchange
[그림 5] DXMS分析을 利用한 solution에서 Gα의 構造的인 變化(α5와β1만 比較), HX: The changes in amide hydrogen?deuterium exchange
왼쪽의 그림과 같이 G-protein은 Gα와 Gβγ로 이루어져있다. Gα는 파란色으로 標示되어 있고,Gβγ는 빨간色과 綠色으로 標示되어 있다. Gβγ는 異量體를 이루고 있으며,Gα는 GαsAH와 GαsRas로 이루어져있다. 非活性化 狀態에서는 Gα는 GDP와 Gβγ에 단단히 結合되어 있다. 受容體에 리간드(ligand)가 結合하게 되면 活性化狀態로 바뀌면서 GPCR과 G-protein의 構造가 바뀌게 된다. GαsRas가 GTP 加水分解에 必要한 觸媒役割의 residue를 包含하고 있으며 또한 effector protein과 Gβγ의 結合部位度 가지고 있다. GαsAH는
뉴클레오티드
(nucleotide) 放出에서 조개껍집과 같이 열리는 役割을 한다. G-protein이 活性化 될 때 構造的인 變化를 좀 더 具體的으로 分析하기 위해서 決定構造(Crystal structure)가 提示하는 政敵인 洞察과 함께
DXMS
(peptide amide hydrogen-deuterium exchange mass spectrometry)라는 分析法을 利用하였고, 이러한 保安을 통해서 좀 더 力動的인 洞察을 提示할 수 있었다. 旣存의 決定構造(Crystal structure)에서 알고 있던 事實 뿐만 아니라 決定構造가 밝혀낼 수 없었던 것까지 밝혀낼 수 있었다.
DXMS分析法 利用
[
編輯
]
G蛋白質이 이질삼合體를 이루고 있을 詩에 비해 Gα와 受容體가 複合體를 이루고 있을 때를 比較했을 때(그림5,a) , Gα 單位體에서 α5-helix의 카覆試末端(C-terminus)은 減少된 水素-重水素 交換을 보였다. 이를 通해 α5-helix가 複合體를 이룰 時에 受容體를 貫通한다는 것을 알았다. 또한 α5-helix의 아미노末端은 增加된 交換을 보였다. 이는 α5-helix의 아미노末端이 뉴클레오티드 結合部分에 關與하고 있기 때문인데, 複合體를 이루면서 GDP가 떨어져나가기 때문에 뉴클레오티드 結合 地域은 열리게 되고 그러므로 水素-重水素 交換은 增加하게 되는 것이다. 複合體를 이루었을 때와 GDP+AlF3를 添加했을 때를 比較하는 境遇(그림5,b)에서 GDP+AlF3는 G蛋白質과 結合했을 때, GTP와 構造的으로 機能的으로 거의 같은 役割을 한다. GTP가 結合된 G蛋白質은 受容體와 Gβγ 單位體으로부터 떨어지게 된다. 그러므로 Gα의 α5-helix는 露出이 되게 되고 水素-重水素 交換은 增加하게 된다. 當然히 GDP+Al3의 結合으로 因해 뉴클레오티드 結合 部分은 닫히게 되고, 그에 따라 α5-helix의 아미노末端은 水素-重水素 交換이 減少하게 되는 것이다. GDP를 添加했을 時에는 GDP+AlF3를 添加했을 때와 거의 類似한 樣相을 보였다(그림5,c). 하지만 GDP+AlF3을 添加했을 때 만큼의 比率만큼 變化된 樣相은 보이지 않았다. 이러한 結果는 GDP가 結合된 G蛋白質의 α5-helix가 受容體와 弱하게 結合하고 있다는 것을 暗示한다.
DXMS分析이 밝혀낸 가장 두드러진 部分은 바로 β1-strand의 構造的인 變化이다. β1-strand은 ICL2와 GDP의 β-phosphate를 調整하는 P-loop를 連結한다. 이 β1-strand의 部分은 決定構造에서는 작은 變化를 보여주기 때문에, GDP放出을 위해 必要한 構造的인 變化를 잘 反映하지 못했다. 하지만 DXMS分析法에서는 P-loop,α1,β1,그리고 α5의 아미노末端은 GDP放出視 水素-重水素의 높은 交換比率을 보였다. 結果的으로 DXMS의 硏究는 β1-P-loop-α1 區域이 amide backbone 水素結合을 變更시키는 構造的인 變化를 겪는다는 것을 알아냈다. 이를 통해서 이들 地域이 뉴클레오티드 結合에 關與하고 있다는 것을 알게 된 것이다.
또한 DXMS 分析을 통해 뉴클레오티드 結合과 關聯하여 GαsAH와 GαsRas(G蛋白質GαsAH와 GαsRas로 構成되어 있다)는 조개껍질같은 構造的인 變化를 겪는다는 것을 알아냈다. 뉴클레오티드가 없을 時에 이러한 조개껍질같은 열림이 일어나는데, 이때 GαsAH가 그 自體로는 접힘과 構造가 거의 그대로이며 位置的으로만 再配列이 일어나는 것을 알아냈다.
결론적으로 DXMS 分析法은 結晶構造의 政敵인 洞察을 補充하여 좀 더 仔細하고 力動的인 洞察을 提示하였다. 이를 通해 G-蛋白質의 構造가 더 具體化되었다.
醫學的 價値
[
編輯
]
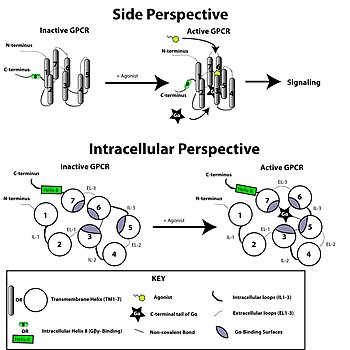 [그림 6] GPCR의 active state와 inactive state間의 構造的인 差異
[그림 6] GPCR의 active state와 inactive state間의 構造的인 差異
醫學的 價値에서는 以前에 살펴본 信號 傳達 體系 및 構造的인 觀點을 통해 GPCR을 目的地로 하는 藥 開發 可能性을 摸索해보자 한다. 앞에서의 信號傳達體系와 構造分析에서 말했듯이, GPCR은 外部에 存在하는 리간드에 담겨 있는 信號를 받아들여서 細胞 內의 反應을 誘導하여 리간드에 特定 反應을 誘導한다. 이는 곧 構造的인 觀點에서 보았을 때 리간드가 GPCR의 特定 構造的인 變化를 誘導하여 G-蛋白質이 細胞內의 位置에서 더 잘 結合하도록 도와주거나, GRK를 通해 GPCR의 C-末端을 燐酸化시켜 β-arrestin-仲裁 信號傳達體系를 誘導시킨다.(혹은 β-arrestin은 GPCR의 構造的인 變化가 나타났을 때 GRK를 거치지 않더라도 直接 GPCR과 相互作用을 가져 細胞 內의 信號傳達, desensitization, 食作用 等의 反應을 誘導할 수 있다.) 卽, 細胞 內의 變化를 일으키는 리간드 或은 agonist는 特定 信號傳達體系만을 活性化시키는, “biased agonist”의 特性을 가진다. 어떤 論文에서는 이 特性을 “efficacy is pluridimensional rather than linear”라 整理하기도 한다.
리간드는 親和力(리간드와 受容體間의 相互 作用의 세기)와 內部的 效驗 (受容體에 結合한 리간드가 얼마나 反應을 잘 誘導할 수 있는가)의 特性에 따라서 크게 4個의 種類로 나눌 수 있다.(full agonist, partial agonist, neutral agonist, inverse agonist) full agonist와 partial agonist는 GPCR의 活性化된 形態를 安定化시키며, inverse agonist, 卽 antagonist는 비활성화된 形態를 安定化시킨다. 特히 GPCR에 특정한 結合을 하는 藥을 開發하는 데에 있어서 候補 藥물이 어느 그룹에 屬하는지 實驗的으로 確認하는 것은 매우 重要한 過程이다. 어느 實驗室에서는 各各의 리간드 族이 GPCR에 結合하였을 때 생기는 構造的인 差異, 그 中에서도 ECL 2/3間의 鹽다리 連結의 世紀에 差異가 난다는 것에 着眼하여 Lys305와 Asp192 間의 相互作用을 마커로 使用하여 同位元素 表示를 통해 Lys305 最高點의 位置를 把握하여 리간드의 特性을 把握하는 硏究가 進行되었다.
最近에는 위의 信號傳達體系를 利用한 分析뿐만이 아니라 構造基盤的인 藥 開發 技法 또한 많이 利用되고 있다. 構造를 基盤으로 한 藥의 探索은 候補 中에서의 最適化 및 새로운 藥을 찾을 수 있다. 이의 代表的인 例가 바로 In silico docking method이다. 이 技法은 full agonist와 partial agonist가 活性化 된 形態를 安定化시키고 antagonist가 비활성화된 形態를 安定化시킨다는 것에 着眼하여 리간드에 結合한 GPCR을 精製하는 方法이다. 勿論, 이 方法은 아직 限界點을 가지고 있다. 于先 리간드를 通해 GPCR을 精製해내는 데에 있어서 GPCR과 弱한 相互作用을 하는 리간드를 利用할 수는 없다. 또한 앞에서도 살펴보았듯이 G-蛋白質의 結合, 리간드와 GPCR의 種類 等에 따라서 構造의 多樣性을 가진다는 點에서
In silico
docking은 限界點을 지니고 있다. 따라서 GPCR을 標的으로 하는 藥을 開發할 때에는 單純히 結合만 생각할 뿐만이 아니라 GPCR의 力動的인 特性 理解하여야 할 것이다.
같이 보기
[
編輯
]
參考 資料
[
編輯
]
外部 링크
[
編輯
]