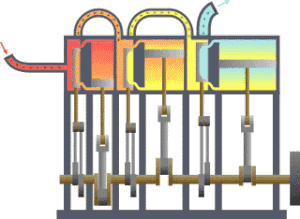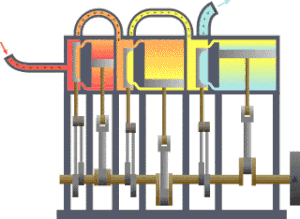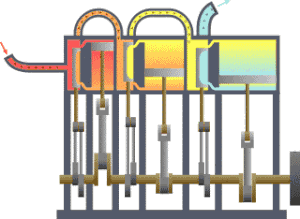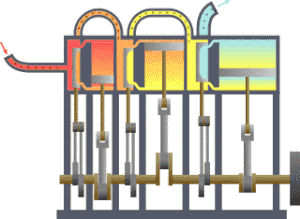
 一?典型的
熱力學系統
,?????(??)流向?冷?(冷凝器),在?一?程中有一系列活塞做了
功
。
一?典型的
熱力學系統
,?????(??)流向?冷?(冷凝器),在?一?程中有一系列活塞做了
功
。
?力?
(法語:
thermodynamique
,德語:
Thermodynamik
,英語:
thermodynamics
,源於
古希??
θερμ??及δ?ναμι?),是?究??象中
物?
??和
能量
???律的?科。?着重?究物?的平衡??以及?準平衡?的物理、化??程。?力?定義許多
巨觀
的物理量(像
溫度
、
內能
、
?
、
壓?
等),描述各物理量之間的關係。?力?描述數量非常多的微觀粒子的平均行?,其定律可以用
統計力學
推導而得。
熱力學可以總結?四條定律:
- 熱力學第零定律
定義了?度這一物理量,指出了相互接觸的??系統,熱流的方向。
- 熱力學第一定律
指出?能這一物理量的存在,?且與系統整體運動的動能和系統與環境相互作用的位能是不同的,區分出熱與功的轉換。
- 熱力學第二定律
涉及的物理量是?度和?。?是?究不可逆?程引入的物理量,表征系統透過熱力學過程向外界最多可以做多少熱力學功。
- 熱力學第三定律
認?,不可能透過有限過程使系統冷却到
?對零度
。
熱力學可以應用在許多科學及工程的領域中,例如:
引擎
、
相變化
、
化學反應
、
輸運現象
甚至是
黑洞
。熱力學計算的結果不但對
物理
的其他領域?重要,對
航空工程
、
航海工程
、
車輛工程
、
機械工程
、
細胞生物學
、
生物醫學工程
、
化學
、
化學工程
及
材料科學
等科學技術領域也?重要,甚至也可以應用在
經濟學
中
[1]
[2]
,?見「
熱經濟學
」。
?力?是?18世?末期?展起?的理?,主要是?究
功
與
?量
之間的能量轉換;在此功定義?
力
與
位移
的
內積
;而熱則定義?在熱力系統邊界中,由
溫度
之差所造成的
能量
傳遞。兩者都不是存在於熱力系統內的性質,而是在熱力過程中所?生的。
熱力學的?究一開始是?了提昇
蒸汽引擎
的
效率
,早期
尼古拉·?諾
有許多的貢獻,他認?若引擎效率提昇,法國有可能?得
拿破崙戰爭
[3]
。出生於愛爾蘭的英國科學家
開爾文
在1854年首次提出了熱力學明確的定義
[4]
:
| “
|
熱力學是一門描述熱和物體中各部?之間作用力的關係,以及描述熱和電器之間關係的學科。
|
”
|
一開始熱力學?究關注在
熱機
中
工質
(如
蒸氣
)的熱力學性質,後來延伸到
化??程
中的能量轉移,例如在1840年科學家
杰?因·亨利·盖斯
提出,有關化學反應的能量轉移的?究
[5]
。
化學熱力學
中?究
?
對
化學反應
的影響
[6]
[7]
[8]
[9]
[10]
[11]
[12]
[6]
[13]
[14]
。統計熱力學也稱?
統計力學
,利用根據微觀粒子力學性質的
統計學
預測來解釋巨觀的熱力學性質。
簡介
[
??
]
熱力學一詞一般是指物體和過程的巨觀描述
[15]
:「古典熱力學和個別原子的性質無關」
[16]
。「統計熱力學」會用個別原子的性質來描述物體和過程,主要是將其描述?一群有類似特性的粒子,彼此的機率都相同。
熱力學最早是在?究能量的轉移,藉由巨觀變數可以將能量轉移分?二類:
熱
和
功
[17]
[18]
。
熱力學平衡
是熱力學中幾個最重要?念中的一個
[19]
。一個熱力學平衡系統的
溫度
可以明確定義,可能也是熱力學中最有代表性的物理量。若系統及過程不在熱力學平衡的狀態,就?難進行精確的熱力學?究。不過在工程的應用中,往往會通???的近似?算,用平衡熱力學中的物理量,得到較實用的數?。在許多實際的系統中(例如
熱機
及
?箱
),系統會包括數個有不同溫度和壓?的子系統,若這些子系統的熱力學變數已足?接近明確定義的情形,就可以用較有效的方法來求解熱力學系統的變數。
?力?最基?的?念是
系?
和
?境
[20]
。一??力?系?的?境是?之相互作用的其他?力?系?。?力??境的一?典型例子是?浴,使系?的?度?持在某特定?,具?的相互作用形式可不去?心。
?力?最基本的??是?力???和?力??程。?力?中的推理可基于?力???或?力?循??程。
?力?系?可由其???描述,?力?系?是?宏?物理?象,由描述宏?性?的物理和化??量描述。所需的宏???量?具?的??而定。
?力?系?可由其所??的?程?描述,尤其是循??程,?也是?力??立者所采用的方法。
?力?和???力??用于?究某一?系的?程,?程中分子的??可分???:
- 快速??,在所?究的?程的??尺度上,分子可以遍??所有可能的??,使?系?快?到?力?平衡。
- 慢速??,在所?究的?程的??尺度上,可忽略分子??。
[21]
[22]
如果宏??程中,分子??介于快速??和慢速??之?,在所?究的?程的??尺度上,系?一般?于非平衡?。分?分子??的??尺度是?力?中?常考?的??。
例如,?典?力?主要是?究物?的
??方程
,宏?力?量和?度比?境的?化要快?多,??上是?究?力?平衡下的???量。??方程表述的是系?的本?特性。??方程常???强是??和?度的函?。
[23]
[24]
[25]
[26]
本?目以由?入深的方式介??力?,先介?循??程和?力?平衡?,最后介??力?非平衡?。
?力?史
[
??
]
 ?力?始?八?派的代表性科學家
?力?始?八?派的代表性科學家
?力?史
可追溯到1650年
格里克
??和建造了世界上第一?
?空?
,?用
?德堡半球
???明了
?空
的存在,推?了
?里士多德
提出的“
自然界???空
”的假?。1656年,物理?家和化?家
?伯特·波?耳
借?格里克的??,?
?伯特·胡克
?明了
抽?机
[27]
。利用抽?机,波?耳和胡克?明了
?强
、
?度
和
??
之?有一定的?系,波?耳?出了
波?耳定律
,?于一定?度下的一定量的??,?强???成反比。1679年,波?耳的助手
丹尼斯·?潘
?明了
蒸汽蒸煮器
,?是一??密封盖的容器,里面??生高???。?潘后??他?明的蒸煮器做了改?,加?了放???,避免爆炸。?潘?察到了??的周期性的??,?想出活塞和汽缸蒸汽机,但是他?有去??自己的想法。1697年,工程?
托?斯·塞?利
在?潘的??的基?上,?明了第一?蒸汽机。?后,1712年,
??斯·?科?
也?明了一?蒸汽机。?些早期的蒸汽机非常粗?,效率?低,但吸引了???尖的科?家的注意。
1759年,
詹姆斯·瓦特
?始??蒸汽机,??失?。瓦特向
格拉斯哥大?
的?授
?瑟夫·布拉克
求?。布拉克向其?解了自己提出的
?容
和
??
的?念,瓦特?想出了分?冷凝器的想法,?于?著提高了蒸汽机的效率
[a]
。
尼古拉·??
??前人工作,在1824年?表著作《
?火的?力
》。?部著作?述了
???机
和
??循?
的?系。?部著作是?力?成??代科?的?志,??也被?作?力?之父。
19世?50年代,?力?第一和第二定律同?形成,主要完成者是
威廉·?翰·??恩·?金
、
?道夫·克?修斯
和
威廉·?姆森
。1859年,史上第一部?力??科?出版,作者是?金。
[28]
???力?的?立者包括:
馬克士威
、
???曼
、
普朗克
、克?修斯、
吉布斯
。
分支?科
[
??
]
?力?系?是理?上?建出?,以
?力?定律
?究有物?和能量交?的物理系?。?力?系?的?究可分???分支?科,各自有不同的基本模型,或采用不同的原理。
?典?力?
[
??
]
?典?力?用不???改?的平衡?或者??的循??程描述和?究?力?系?。?用的物理量是不???改?的??可?量的宏?平衡?的物理量,?物理量的???平均的量不???改?,比如循??程的流。
局域平衡??力?
[
??
]
?展?力?
[
??
]
???力?
[
??
]
熱力學定律
[
??
]
- 熱力學第零定律
:在不受外界影?的情?下,只要A和B同??C?于?平衡,?使A和B?有?接?,他?仍然?于?平衡??。??定律?明,互相?于?平衡的物?之?必然具有相等的?度。
- 熱力學第一定律
:
能量守恒定律
?非
孤立系?
的?展。此?能量可以以
功
W
或
?量
Q
的形式?入或?出系?。?力?第一定律表?式?:

- 熱力學第二定律
:
孤立系統
?(失序)
不會減少──簡言之,熱不能自發的從冷處轉到熱處,而不引起其他?化。任何高溫的物體在不受熱的情況下,都會逐漸冷?。??定律?明第二?
永?机
不可能制造成功。熱力學第二定律也可表示??增原理:
 。
。
- 熱力學第三定律
:完整晶?於
?對溫度
零度時(?攝氏-273.15度),?增?零。
系統模型
[
??
]
各種熱力學系統中允許的質量或能量交換方式
| 熱力學系統分類
|
交換方式
|
|
|
質量
|
功
|
熱
|
| 開放系統
|
 Y Y
|
 Y Y
|
| 封閉系統
|
 N N
|
 Y Y
|
 Y Y
|
| ?熱封閉系統
|
 N N
|
 Y Y
|
 N N
|
| 力學封閉系統
|
 N N
|
 N N
|
 Y Y
|
| 孤立系統
|
 N N
|
 N N
|
 N N
|
 熱力學系統的示意圖
熱力學系統的示意圖
熱力學系統
是熱力學的重要?念之一,是指一塊有明確定義的區域,所有不在熱力學系統內的區域合稱?
環境
,系統和環境之間是由邊界隔開,系統和環境透過邊界才能交換物質、
功
或熱。
邊界就是包圍系統外圍的表面,任何通過表面,會影響系統內能的都需要在能量平衡方程式中考慮。像
?克斯·普朗克
在1900年時的?究就將系統定義?單一原子周圍有共振能量的區域,
薩迪·?諾
在1824年將系統定義?
蒸汽机
中的蒸氣,
克里·伊曼紐爾
在1986年有關
大氣熱力學
的?究中將系統定義?
熱帶氣旋
的本體。在
量子統計力學
中會將
核素
(一個由?克組成的系統)定義?一個系統。
邊界可分?四種:固定、活動、??、虛構。在引擎中的固定邊界是指活塞固定在某特定位置,因此在等容過程中,不會?生功。而在引擎中的活動邊界是指允許活塞移動位置,因此可以?生功。在封閉系統中,邊界是??的,而在開放系統中,邊界多半是虛構的。
[29]
系統可以依邊界允許的質量或能量交換方式來分類,簡單分類可以分?以下三類:
- 孤立系統
:系統完全不與外界交換能量或質量。
- 封閉系統
:系統只與外界交換能量而不交換質量。
- 開放系統
:系統與外界交換能量和質量。
但若將能量再細分?功和熱,封閉系統可以再多區分出二類,其性質介於封閉系統和孤立系統之間:若系統不允許外界交換熱,只能有功的交換,稱??熱封閉系統或
熱孤立系統
,若系統不允許外界交換功,只能有能的交換,稱?Adynamically封閉系統
[30]
,也稱作
力學孤立系統
。
熱力學設備
[
??
]
 ?諾循環
,其中的
T
H
和
T
C
就是高溫熱庫及低溫熱庫
?諾循環
,其中的
T
H
和
T
C
就是高溫熱庫及低溫熱庫
熱力學設備
可分?二種,分?是儀表(meter)和源(reservoir)。熱力學儀表是指任何可以量測熱力學系統中參數的設備。有時熱力學的參數是用理想的量測儀表來定義,例如
熱力學第零定律
說明若二個物體分別和一個物體達到熱平衡,這二個物體之間也達到了熱平衡。
馬克士威
在1872年時提出熱力學第零定律,也提到可以量測溫度的方式。理想的
溫度計
是在定壓下定量的
理想氣體
,根據
理想氣體定律
 ,氣體的體積?可用來表示壓?,雖然壓?是用力學的方式定義,也可以用定溫下定量的
理想氣體
的體積來當作理想的
??表
。
?量?
則是量測系統內能及能量變化的設備。
,氣體的體積?可用來表示壓?,雖然壓?是用力學的方式定義,也可以用定溫下定量的
理想氣體
的體積來當作理想的
??表
。
?量?
則是量測系統內能及能量變化的設備。
熱力學源是指一個?大的系統,和測試系統接觸時其特定狀態幾乎不會變化。熱力學源一般是用來將系統的狀態施加到某一特定數?。像壓?源是在特定壓?下的系統,和其他系統連接後,會使其他系統的壓?等於該特定?。地球的大氣常作?壓?源。熱力學中常見的熱力學源是熱庫,是特定溫度下的系統,像
?諾循環
中就用到了高溫熱庫及低溫熱庫。
[31]
共?變數
[
??
]
能量
是熱力學的中心?念之一。
熱力學第一定律
說明系統和環境的總能量守?。若要加入能量到系統中,可以透過加熱、壓縮、加入物質的方式。若要從系統中提出能量,則可以透過冷?、膨脹、移出物質的方式。例如在
力學
的能量轉移等於對一物體的施力及物體的位移。
共?變數
是成對的熱力學?念,其中第一個表示施加在熱力學系統中的某種「力」,第二個則表示熱力學系統上的某種「位移」,二者的乘積??轉移的能量。常見的共?變數有:
局限性
[
??
]
熱力學由於發展較早,也有其自身的局限性,主要表現在:
- ?僅適用於粒子?多的宏觀系統;
- ?主要?究物質在平衡態下的性質,?不解答系統達到平衡態的詳細過程;
- ?把物質視作“連續體”,不考慮物質的微觀結構。
??物理?
??力??合起??究??象常常可以??以上局限性
[32]
。
子?科
[
??
]
注?
[
??
]
- ^
The Newcomen engine was improved from 1711 until Watt's work, making the efficiency comparison subject to qualification, but the increase from the Newcomen 1765 version was on the order of 100%.
?考文?
[
??
]
- ^
Smith, J.M.; Van Ness, H.C.; Abbott, M.M. Introduction to Chemical Engineering Thermodynamics. McGraw Hill. 2005.
ISBN
0-07-310445-0
.
OCLC 56491111
.
- ^
Haynie, Donald, T. Biological Thermodynamics. Cambridge University Press. 2001.
ISBN
0-521-79549-4
.
OCLC 43993556
.
- ^
Clausius, Rudolf. On the Motive Power of Heat, and on the Laws which can be deduced from it for the Theory of Heat. Poggendorff's
Annalen der Physik
, LXXIX (Dover Reprint). 1850.
ISBN
0-486-59065-8
.
- ^
Sir William Thomson, LL.D. D.C.L., F.R.S.
Mathematical and Physical Papers
1
. London, Cambridge: C.J. Clay, M.A. & Son, Cambridge University Press. 1882: 232
[
2013-05-10
]
. (原始?容
存?
于2013-06-20).
- ^
Hess, H. (1840).
Thermochemische Untersuchungen
(
?面存???
,存于
互???案?
),
Annalen der Physik und Chemie
(Poggendorff, Leipzig)
126
(6): 385?404.
- ^
6.0
6.1
Enrico Fermi.
Thermodynamics
. Courier Dover Publications. 1956: ix.
ISBN
0-486-60361-X
.
OCLC
230763036
、
54033021
.
- ^
Gibbs, Willard, J. (1876).
Transactions of the Connecticut Academy
, III, pp. 108?248, Oct. 1875 ? May 1876, and pp. 343?524, May 1877 ? July 1878.
- ^
Duhem, P.M.M. (1886).
Le Potential Thermodynamique et ses Applications
, Hermann, Paris.
- ^
Lewis, Gilbert N.; Randall, Merle.
Thermodynamics and the Free Energy of Chemical Substances
. McGraw-Hill Book Co. Inc. 1923.
- ^
Guggenheim, E.A. (1933).
Modern Thermodynamics by the Methods of J.W. Gibbs
, Methuen, London.
- ^
Guggenheim, E.A. (1949/1967)
- ^
Ilya Prigogine, I. & Defay, R., translated by D.H. Everett. Chemical Thermodynamics. Longmans, Green & Co., London. Includes classical non-equilibrium thermodynamics. 1954.
- ^
Perrot, Pierre. A to Z of Thermodynamics. Oxford University Press. 1998.
ISBN
0-19-856552-6
.
OCLC
123283342
、
38073404
.
- ^
Clark, John, O.E.
The Essential Dictionary of Science
. Barnes & Noble Books. 2004.
ISBN
0-7607-4616-8
.
OCLC
58732844
、
63473130
.
- ^
Reif, F.
Fundamentals of Statistical and Thermal Physics
. New York: McGraw-Hill Book Company. 1965: 122.
- ^
Fowler, R., Guggenheim, E.A. (1939).
Statistical Thermodynamics
, Cambridge University Press, Canbridge UK. p. 3.
- ^
Bridgman, P.W. (1943).
The Nature of Thermodynamics
, Harvard University Press, Cambridge MA, p. 48.
- ^
Partington, J.R. (1949).
An Advanced Treatise on Physical Chemistry
, volume 1,
Fundamental Principles. The Properties of Gases
, Longmans, Green and Co., London. page 118.
- ^
Tisza, L. (1966).
Generalized Thermodynamics
, M.I.T Press, Cambridge MA p. 18.
- ^
Kondepudi, D. (2008).
Introduction to Modern Thermodynamics
, Wiley, Chichester,
ISBN 978-0-470-01598-8
. Includes local equilibrium thermodynamics.
- ^
Fowler, R., Guggenheim, E.A. (1939), p. 13.
- ^
Tisza, L. (1966), pp. 79?80.
- ^
Planck, M. 1923/1926, page 5.
- ^
Partington, p. 121.
- ^
Adkins, pp. 19?20.
- ^
Haase, R. (1971), pages 11?16.
- ^
Partington, J.R.
A Short History of Chemistry
. Dover. 1989.
OCLC 19353301
.
- ^
Cengel, Yunus A.; Boles, Michael A. Thermodynamics ? an Engineering Approach. McGraw-Hill. 2005.
ISBN
0-07-310768-9
.
- ^
Lauth,Gunter J.; Kowalczyk, Jurgen. Thermodynamik: Eine Einfuhrung. Springer Spektrum. 2015.
ISBN
978-3-662-46228-7
.
- ^
Partington, J.R. (1913).
A Text-book of Thermodynamics
, Van Nostrand, New York, page 37.
- ^
Windisch, Herbert. Thermodynamik: Ein Lehrbuch fur Ingenieure Auflage 5. De Gruyter Oldenbourg. 2014.
ISBN
978-3-486-77847-2
.
- ^
秦允豪. 《??》(第二版). 高等?育出版社. : 第3?.
ISBN
978-7-04-013790-3
.
??
[
??
]
|
|---|
| | ?念
| |
|---|
| | 技術
| |
|---|
| | 設備
| |
|---|
| | 測量與控制
| |
|---|
| | 職業、行業與服務
| |
|---|
| | 工業組織
| |
|---|
| | 健康與安全性
| |
|---|
| | 參見
| |
|---|
|