С Википеди?е, слободне енциклопеди?е
Kalijum sulfid
|
| Nazivi
|
| IUPAC naziv
Kalijum sulfid
|
| Drugi nazivi
Dikalijum monosulfid,
Dikalijum sulfid,
Kalijum monosulfid,
Kalijum sulfid
|
| Identifikacija
|
|
|
|
|
|
|
| ECHA InfoCard
|
100.013.816
|
|
|
|
| RTECS
|
TT6000000
|
|
|
|
|
| Svojstva
|
|
|
K
2
S
|
| Molarna masa
|
110,262 g/mol
|
| Agregatno stanje
|
?ist: bezbojan
sa ne?isto?ama: ?uto-braon
|
| Miris
|
HS
|
| Gustina
|
1,74 g/cm
3
|
| Ta?ka topljenja
|
840 °C
|
| Ta?ka klju?anja
|
912 °C (razla?e se)
|
|
|
kovertuje se u KSH, KOH
|
| Rastvorljivost
u drugi rastvara?i
|
rastvoran u
etanolu
,
glicerolu
nerastvoran u
etru
|
| Struktura
|
| Kristalna re?etka/struktura
|
anti
Fluorit
|
| Opasnosti
|
| Opasnost u toku rada
|
Opasan za sredinu (
N
)
|
| R-oznake
|
R17
,
R23
,
R25
,
R31
,
R34
,
R50
|
| S-oznake
|
S24
,
S26
|
| Srodna jedinjenja
|
|
|
Natrijum sulfid
,
Gvo?đe (II) sulfid
|
Srodna jedinjenja
|
Kalijum hidrosulfid
,
Kalijum sulfit
,
Kalijum sulfat
|
Ukoliko nije druga?ije napomenuto, podaci se odnose na
standardno stanje
materijala (na 25 °C [77 °F], 100 kPa).
|
 Y
verifikuj
(
?ta je Y
verifikuj
(
?ta je
 Y Y
 Н
?) Н
?)
|
| Reference infokutije
|
|
|
|
Kalijum sulfid
je
neorgansko jedinjenje
sa formulom K
2
S.
[3]
[4]
Ova bezbojna ?vrsta materija se retko sre?e, jer brzo reaguje sa vodom, pri ?emu se formiraju
kalijum hidrosulfid
(KSH) i kalijum hidroksid (KOH). Naj?e??e se termin kalijum sulfid koristi u ?irem smislu za ovu me?avinu, a ne za anhiratni prah.
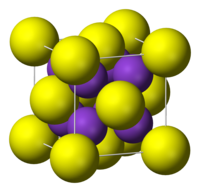
On poprima "antifluoritnu strukturu", ?to zna?i da mali K
+
joni zauzimaju tetraedralna (F
?
) mesta u
fluoritu
, i veliki S
2?
centri imaju osam koordinatnih mesta.
Li
2
S
,
Na
2
S
, i Rb
2
S imaju sli?nu kristalnu strukturu.
[5]