Полони?ум
 |
|
| Име,
симбол
| полони?ум, Po
|
|---|
| Алотропи
| α, β
|
|---|
| Изглед
| сребрнаст
|
|---|
|
|
|
|
| Атомски бро?
(
Z
)
| 84
|
|---|
| Група
,
периода
| група 16 (халкогени)
,
периода 6
|
|---|
| Блок
| p-блок
|
|---|
| Категори?а
|
постпрелазни метал
, али та? статус ?е оспорен
|
|---|
| Рел. ат. маса
(
A
r
)
| 208,9824308(20)
[1]
|
|---|
| Масени бро?
| 209 (на?стабилни?и изотоп)
|
|---|
| Ел. конфигураци?а
| [
Xe
] 4f
14
5d
10
6s
2
6p
4
|
|---|
по ?ускама
| 2, 8, 18, 32, 18, 6
|
|---|
|
| Агрегатно ста?е
| чврст
|
|---|
| Тачка топ?е?а
| 527
K
(254
°C
, 489 °F)
|
|---|
| Тачка к?уча?а
| 1235 K (962
°C
, 1764 °F)
|
|---|
| Густина
при
с.т.
| алфа: 9,196
g/cm
3
бета: 9,398
g/cm
3
|
|---|
| Топлота фузи?е
| ca. 13
kJ/mol
|
|---|
| Топлота испарава?а
| 102,91
kJ/mol
|
|---|
| Мол. топл. капацитет
| 26,4
J/(mol·K)
|
|---|
Напон паре
| P
(Pa)
|
10
0
|
10
1
|
10
2
|
| на
T
(K)
|
|
|
|
| P
(Pa)
|
10
3
|
10
4
|
10
5
|
| на
T
(K)
|
(846)
|
1003
|
1236
| |
|
| Електронегативност
| 2,0
|
|---|
| Енерги?е ?онизаци?е
| 1
: 812,1
kJ/mol
|
|---|
| Атомски ради?ус
| 168
pm
|
|---|
| Ковалентни ради?ус
| 140±4 pm
|
|---|
| Валсов ради?ус
| 197 pm
|
|---|
 Спектралне лини?е Спектралне лини?е
|
|
| Кристална структура
|
кубична
α-Po
|
|---|
|
|
ромбоедарска
β-Po
|
|---|
| Топл. шире?е
| 23,5
μm/(m·K)
(на 25
°C
)
|
|---|
| Топл. вод?ивост
| 20
W/(m·K)
(?)
|
|---|
| Електрична отпорност
| α: 0.40 μΩ·m (на 0
°C
)
|
|---|
| Магнетни распоред
| немагнетан
|
|---|
| CAS бро?
| 7440-08-6
|
|---|
|
| Именова?е
| по
лат.
Polonia
, латински за
По?ска
, домовина Мари?е Кири
|
|---|
| Откри?е
| П?ер
и
Мари?а Кири
(1898)
|
|---|
| Прва изолаци?а
| Вили Марквалд
(1902)
|
|---|
|
|
|
| референце
?
Википодаци
|
Полони?ум
(
лат.
polonium
) ?есте
хеми?ски елемент
са
симболом
Po
и
атомским бро?ем
84. Открили су га 1898. године
Мари?а Кири
и
П?ер Кири
. То ?е редак и веома
радиоактиван
елемент без стабилних
изотопа
. У хеми?ском аспекту, полони?ум ?е веома сличан
бизмуту
и
телуру
, а ?ав?а се у склопу руда
урани?ума
. Посто?и врло мали бро? области где се користи полони?ум. Осим као средство за генерира?е топлоте у свемирским пробама, користи се у антистатичким уре?а?има и као извор
неутрона
и алфа-честица. Због свог места у
периодном систему
, где ?е уврштен у
VIA
групу, полони?ум се понекад сматра
металоидом
.
[3]
Ме?утим, други извори наводе да ?е он без сум?е метал, што доказу?у на бази особина и делова?а полони?ума.
[4]
Рани?е провизорно назван
ради?ум Ф
, полони?ум су открили
Мари?а
и
П?ер Кири
1898. године,
[5]
и дали му име у част Мари?ине домовине
По?ске
(лат.
Polonia
).
[6]
[7]
Данаш?а По?ска у то време ?е била поде?ена изме?у
Руског царства
,
Немачке
и
Аустроугарске
па ни?е посто?ала као независна зем?а. Кири?ева нада ко?ом се руководила при дава?у имена елемента ?е била да ?е то имати од?ека у свету и скренути паж?у на по?ску теж?у ка независнош?у.
[8]
Полони?ум ?е био први елемент ко?и ?е добио име у сврху наглашава?а неке политичке контроверзе.
[8]
Ова? ?е елемент први ко?и су открили Кири?еви док су истраживали радиоактивност минерала
уранинита
. Та? минерал, након издва?а?а радиоактивних елемената
урани?ума
и
тори?ума
из ?ега, био ?е ?ош више радиоактиван него кад ?е садржавао та два елемента. Та по?ава навела ?е Кири?е у потрагу за другим радиоактивним елементима садржаним у ураниту. Из ?ега су прво издво?или полони?ум у ?улу 1898. а пет месеци касни?е изоловали су
ради?ум
.
[9]
[5]
[10]
У С?еди?еним Америчким Државама, полони?ум се производио као део потпро?екта
Да?тон
у склопу
про?екта Менхетн
током Другог светског рата. Он ?е био критични део
нуклеарног оруж?а
имплозивног типа ко?е се користило у бомби
Fat Man
бачено? на
Нагасаки
9. аугуста 1945. године. Полони?ум и
берили?ум
били су основни састо?ци модулисаног неутронског детонатора типа
?еж
, ко?и ?е постав?ан у средиште сферно конструисаног
плутони?умског
?езгра бомбе. Детонатор
?еж
?е покретао
ланчану нуклеарну реакци?у
у тренутку достиза?а критичне масе чиме се осигуравало исправно детонира?е бомбе.
[11]
Ве?и део основних физичких и хеми?ских особина полони?ума крио се све до завршетка Другог светског рата. Чи?еница да ?е кориштен као детонатор била ?е повер?ива информаци?а у во?сци САД све до 1960-их.
[12]
Комиси?а за атомску енерги?у САД
и
про?екат Менхетн
вршили су експерименте на ?удима, користе?и полони?ум да?у?и га петеро особа на Универзитету у Рочестеру изме?у 1943. и 1947. године. Тим ?удима су давали изме?у 9 и 22 микрокири?а (330 до 810 kBq) полони?ума проучава?у?и начин ?еговог излучива?а из ?удског организма.
[13]
[14]
[15]
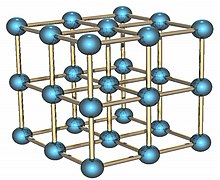 Алфа облик чврстог полони?а.
Алфа облик чврстог полони?а.
Полони?ум ?е радиоактивни елемент ко?и посто?и у две
металне модификаци?е
. Алфа модификаци?а ?е ?едини познати пример ?едноставне
кубне кристалне структуре
на бази ?едног атома, чи?а ?е ивица дужине 335,2 пикометара; док ?е бета модификаци?а ромбоедарске структуре.
[16]
[17]
[18]
Карактеристика структуре полони?ума ?е
дифракци?а
(прелама?е)
x-зрака
[19]
[20]
и
дифракци?а електрона
.
[21]
210
Po (обично за?едно са
238
Pu
) има могу?ност лаког
доспева?а у ваздух
: ако се ?егов узорак загре?е у присуству ваздуха на 55 °C, oko 50% те количине испари у периоду од 45 сати у облику двоатомских Po
2
молекула, иако ?е
тачка топ?е?а
полони?ума 254 °C, а тачка к?уча?а 962 °C.
[22]
[23]
[24]
Посто?и неколико претпоставки за ову по?аву; а ?една од хипотеза ?е да се при алфа-распаду од узорка одломе мале групе атома полони?ума.
Хеми?ске особине полони?ума сличне су онима
телура
и бизмута. Полони?ум се лако
раствара
у разблаженим киселинама, али му ?е раствор?ивост у базама врло слаба. Раствори полони?ума на?при?е поприма?у ружичасту бо?у због
?она
Po
2+
, да би недуго затим врло брзо постали жути због алфа-ради?аци?е из полони?ума ко?и ?онизу?е раствор и претвара ?оне Po
2+
у Po
4+
. Ова? процес ?е пра?ен настанком балончи?а гаса и емиси?ом топлоте и светлости из стакленог посу?а ?ер оно
апсорбу?е
алфа-зраке. Као резултат, раствори полони?ума врло лако испарава?у и могу за неколико дана потпуно испарити ако посуда ни?е чврсто затворена.
[9]
[25]
Полони?ум има
33 позната изотопа
, од ко?их су сви радиоактивни. Они има?у
атомске масе
у распону од 188 до 220
u
. Изотоп
210
Po (
време полураспада
138,376 дана) ?е на?више кориштен и доступан.
209
Po (са временом полураспада од 125,2 ± 3,3 године) ?есте полони?умов изотоп са на?дужим временом полураспада од свих ?егових изотопа.
[2]
Та? изотоп за?едно са изотопом
208
Po (време полураспада 2,9 година) се могу добити путем алфа-, протонским или деутери?умским бомбардова?ем
олова
или
бизмута
у
циклотрону
.
[26]
Изотоп
210
Po ?е емитер
алфа-зрака
а има време полураспада од 138,4 дана; распада се директно у сво? к?ерински стабилни изотоп,
206
Pb
. Милиграм (5 кири?а) изотопа
210
Po емиту?е толики бро? алфа честица у секунди колико и 5 грама изотопа
226
Ra
.
[27]
Неколико кири?а (1
кири
?еднак ?е 37 GBq (гига
бекерела
)) изотопа
210
Po иси?ава плаво зраче?е узроковано побу?ива?ем околног ваздуха. Само ?една од 100.000 алфа-емиси?а узроку?е побу?ива?е у
?езгру
ко?е може резултирати емиси?ом
гама зрака
са максималном енерги?ом од 803 KeV.
[28]
[29]
 Интензитет емиси?е наспрам енерги?е фотона за три изотопа полони?ума.
Интензитет емиси?е наспрам енерги?е фотона за три изотопа полони?ума.
Помо?у радиометри?ских метода као што ?е
гама спектроскопи?а
(или користе?и методе хеми?ске сепараци?е након чега се мери активност са бро?ачем ко?и не расипа енерги?у), могу?е ?е мере?е концентраци?е радиоизотопа и разликова?е ?едних од других. У пракси, присутан ?е позадински шум, те у зависности од детектора, ширина лини?е ?е ве?а што отежава идентификаци?у и мере?е
изотопа
. У биолошким и медицинским радовима обично се користи природно присутни
40
K
у свим телесним
ткивима
и течностима као проба подешености опреме и као интерни стандард.
[30]
[31]
На?бо?и начин за тестира?е (и мере?е) многих алфа емитера ?е кориште?е спектроскопи?е алфа-честица. Обично се стави кап?ица испитиваног раствора на метални диск ко?и се затим исушу?е те се доби?а равномерно обложен диск. Он се затим користи као тестни узорак. Ако ?е деб?ина сло?а формираног на диску исувише велика, онда се при мере?у ?ав?а?у прешироке лини?е спектра. Ово се дешава ?ер се део енерги?е алфа честица губи крета?ем кроз сло? активног матери?ала. Алтернативна метода ?е кориште?е сцинтилаци?е интерне течности где ?е узорак помешан са сцинтилираним ?коктелом”. Када се мери емитовано светло, неки уре?а?и ?е забележити количину светлосне енерги?е по сваком дога?а?у радиоактивног распада.
Због несавршености методе течне
сцинтилаци?е
(као што ?е немогу?ност детекци?е свих фотона, тешко?е бро?а?а код заму?ених или обо?ених узорака) и чи?енице да насумично гаше?е може сма?ити бро? фотона генерираних по ?едном радиоактивном распаду, немогу?е ?е пости?и прошире?е алфа спектра доби?еног помо?у течне сцинтилаци?е. Могу?е ?е да ?е ови спектри течне сцинтилаци?е бити суб?ект Гаусовог прошире?а уместо дисторзи?е ко?а се ?ав?а када ?е сло? активног матери?ала на диску превише дебео.
[31]
Тре?и метод распршава?ем енерги?е ради бро?а?а алфа честица састо?и се у употреби полупроводничког детектора.
[31]
Полони?ум се у зем?ино? кори налази у траговима и то само у рудама
урана
. Не може се у ве?о? количини нагомилати у
минералима
због кратког
времена полураспада
. Равнотежна количина ?е око 0,004 mg по ?едно?
тони
. Полони?ум има 33
изотопа
чи?е се атомске масе налазе изме?у 194?218. Не поседу?е посто?ане изотопе. На?посто?ани?и ?е изотоп 209 (време полу распада ?е 105 година), али он се не ?ав?а у природи, него ?е доби?ен услед вештачке синтезе ?едара бизмута бомбардованих
неутронима
. На?посто?ани?и изотоп ко?и се ?ав?а у природи ?е изотоп 210, ко?и има
време полураспада
138 дана.
Полони?ум се у природи ?ав?а као
оксид
. Ипак ?егова количина у
рудама
?е веома мала тако да се у
индустри?и
исплати доби?а?е бомбардова?ем
бизмута
неутронима
. ?егова годиш?а продукци?а у свету износи свега 20- 30
грама
. Знача?ан извор овог елемента ?е распаднути
радон
из
болница
где се ова?
гас
употреб?ава за лече?е
рака
.
Познато ?е неколико ?еди?е?а полони?ума:
хидрид
PoH
2
,
оксиди
: PoO, Po
2
O
3
, PoO
2
и PoO
3
,
сулфид
(по чему се разлику?е од селена и телура),
хлориде
PoCl
2
и PoCl
4
и металоорганска ?еди?е?а. Та ?еди?е?а нема?у практичну употребу због огромних трошкова продукци?е самог полони?ума.
[32]
- ^
Meija, J.; et al. (2016).
?Atomic weights of the elements 2013 (IUPAC Technical Report)”
.
Pure and Applied Chemistry
.
88
(3): 265?291.
doi
:
10.1515/pac-2015-0305
.
- ^
а
б
Boutin, Chad (9. 9. 2014).
?Polonium's Most Stable Isotope Gets Revised Half-Life Measurement”
.
nist.gov
. NIST Tech Beat
. Приступ?ено
9. 9. 2014
.
- ^
?Characterizing the Elements”
. Los Alamos National Laboratory
. Приступ?ено
4. 3. 2013
.
- ^
Hawkes, Stephen J. (2010).
?Polonium and Astatine Are Not Semimetals”
.
Journal of Chemical Education
.
87
(8): 783.
Bibcode
:
2010JChEd..87..783H
.
doi
:
10.1021/ed100308w
.
- ^
а
б
Curie, P.; Curie, M. (1898).
?Sur une substance nouvelle radio-active, contenue dans la pechblende”
[On a new radioactive substance contained in pitchblende]
(PDF)
.
Comptes rendus
(на ?езику: француски).
127
: 175?178.
- ^
Pfutzner, M. (1999). ?Borders of the Nuclear World ? 100 Years After Discovery of Polonium”.
Acta Physica Polonica B
.
30
(5): 1197.
Bibcode
:
1999AcPPB..30.1197P
.
- ^
Adloff J. P. (2003). ?The centennial of the 1903 Nobel Prize for physics”.
Radichimica Acta
.
91
(12?2003): 681?688.
S2CID
120150862
.
doi
:
10.1524/ract.91.12.681.23428
.
- ^
а
б
Kabzinska, K. (1998). ?Chemical and Polish aspects of polonium and radium discovery”.
Przemysl Chemiczny
.
77
(3): 104?107.
- ^
а
б
John, Emsley (2001).
Nature's Building Blocks
. New York: Oxford University Press. стр. 330?332.
ISBN
978-0-19-850341-5
.
- ^
Curie, P.; Curie, M.; Bemont, G. (1898).
?Sur une nouvelle substance fortement radio-active contenue dans la pechblende”
[On a new, strongly radioactive substance contained in pitchblende]
(PDF)
.
Comptes rendus
(на ?езику: француски).
127
: 1215?1217. Архивирано из
оригинала
(PDF)
22. 7. 2013. г
. Приступ?ено
16. 6. 2019
.
- ^
Nuclear Weapons FAQ, Section 4.1, Version 2.04: 20. februar 1999
. Nuclearweaponarchive.org. pristupljeno dana 28.4.2013.
- ^
Restricted data declassification decisions, 1946 to the present (RDD-7)
, 1. januar 2001, U.S. Department of Energy Office of Declassification, preko fas.org
- ^
American nuclear guinea pigs: three decades of radiation experiments on U.S. citizens
Архивирано
на са?ту
Wayback Machine
(30. ?ул 2013). United States. Congress. House. of the Committee on Energy and Commerce. Subcommittee on Energy Conservation and Power
- ^
"Studies of polonium metabolism in human subjects", poglavlje 3 u:
Biological Studies with Polonium, Radium, and Plutonium
, National, Nuclear Energy Series, Volume VI-3, McGraw-Hill, New York, 1950, citirano u:
American Nuclear Guinea Pigs ...
, 1986 Izvje?taj komiteta House Energy and Commerce
- ^
Moss, William i Eckhardt, Roger (1995)
"The Human Plutonium Injection Experiments"
, Los Alamos Science, br. 23.
- ^
Greenwood & Earnshaw 1997
, стр. 753
harvnb грешка: no target: CITEREFGreenwoodEarnshaw1997 (
help
)
- ^
Miessler, Gary L.; Tarr, Donald A. (2004).
Inorganic Chemistry
(3 изд.). Upper Saddle River, N.J.: Pearson Prentice Hall. стр.
285
.
ISBN
978-0-13-120198-9
.
- ^
?The beta Po (A_i) Structure”
.
Naval Research Laboratory
. 20. 11. 2000. Архивирано из
оригинала
4. 2. 2001. г
. Приступ?ено
5. 5. 2009
.
- ^
J., Desando R.; Lange, R. C. (1966). ?The structures of polonium and its compounds?I α and β polonium metal”.
Journal of Inorganic and Nuclear Chemistry
.
28
(9): 1837.
doi
:
10.1016/0022-1902(66)80270-1
.
- ^
H., Beamer W.; Maxwell, C. R. (1946).
?The Crystal Structure of Polonium”
.
Journal of Chemical Physics
.
14
(9): 569.
doi
:
10.1063/1.1724201
.
hdl
:
2027/mdp.39015086430371
.
- ^
Rollier, M. A.; Hendricks, S. B.; Maxwell, L. R. (1936).
?The Crystal Structure of Polonium by Electron Diffraction”
.
Journal of Chemical Physics
.
4
(10): 648.
Bibcode
:
1936JChPh...4..648R
.
doi
:
10.1063/1.1749762
.
- ^
W?s, Bogdan; Misiak et.al., Ryszard (2006).
?Thermochromatographic Separation of
206,208
Po from a Bismuth Target Bombardet with Protons”
(PDF)
.
Nukleonica
.
51
(suppl. 2): s3?s5.
- ^
Lide, D. R., ур. (2005).
CRC Handbook of Chemistry and Physics
(86 изд.). Boca Raton (FL): CRC Press.
ISBN
978-0-8493-0486-6
.
- ^
Thayer, John S. (2010). ?Relativistic Effects and the Chemistry of the Heavier Main Group Elements”.
Relativistic Methods for Chemists
. Challenges and Advances in Computational Chemistry and Physics.
10
. стр. 63?97.
ISBN
978-1-4020-9974-8
.
doi
:
10.1007/978-1-4020-9975-5_2
.
- ^
Bagnall 1962
, стр. 206
- ^
John, Emsley (2011).
Nature's Building Blocks: An A-Z Guide to the Elements
(novo изд.). New York, NY: Oxford University Press. стр.
415
.
ISBN
978-0-19-960563-7
.
- ^
?Polonium”
(PDF)
. Argonne National Laboratory. Архивирано из
оригинала
(PDF)
3. 7. 2007. г
. Приступ?ено
5. 5. 2009
.
- ^
Greenwood & Earnshaw 1997
, стр. 250
harvnb грешка: no target: CITEREFGreenwoodEarnshaw1997 (
help
)
- ^
?210PO α decay”
.
Nuclear Data Center, Korea Atomic Energy Research Institute
. 2000
. Приступ?ено
5. 5. 2009
.
- ^
Gilmore G, Hemingway J (1995).
Practical Gamma-Ray Spectrometry
. Chichester: John Wiley & Sons.
ISBN
978-0-471-95150-6
.
- ^
а
б
в
Knoll, G. (2000).
Radiation Detection and Measurement
. New York: John Wiley & Sons, Inc.
ISBN
978-0-471-07338-3
.
- ^
Parkes, G.D. & Phil, D. (1973).
Melorova moderna neorganska hemija
. Beograd: Nau?na knjiga.
- Miessler, Gary L.; Tarr, Donald A. (2004).
Inorganic Chemistry
(3 изд.). Upper Saddle River, N.J.: Pearson Prentice Hall. стр.
285
.
ISBN
978-0-13-120198-9
.
- John, Emsley (2001).
Nature's Building Blocks
. New York: Oxford University Press. стр. 330?332.
ISBN
978-0-19-850341-5
.
- Gilmore G, Hemingway J (1995).
Practical Gamma-Ray Spectrometry
. Chichester: John Wiley & Sons.
ISBN
978-0-471-95150-6
.
- Parkes, G.D. & Phil, D. 1973. Мелорова модерна неорганска хеми?а.
Научна к?ига
. Београд.
- Bagnall, K. W. (1962).
?The Chemistry of Polonium”
.
Advances in Inorganic Chemistry and Radiochemistry
.
4
. New York:
Academic Press
. стр. 197?226.
ISBN
978-0-12-023604-6
.
doi
:
10.1016/S0065-2792(08)60268-X
. Приступ?ено
14. 6. 2012
.
- Greenwood, Norman N.; Earnshaw, Alan (1997).
Chemistry of the Elements
(2nd изд.). Butterworth?Heinemann.
ISBN
978-0080379418
.