 Структура молекула
метана
: на??едноставни?ег
уг?оводоника
.
Структура молекула
метана
: на??едноставни?ег
уг?оводоника
.
Органска хеми?а
?е област
хеми?е
ко?а се бави
научним
истражива?ем структуре, сво?става, композици?е,
реакци?а
, и припреме (путем
синтезе
или других средстава) ?еди?е?а базираних на
уг?енику
(
уг?оводоника
) и ?ихових деривата.
Та ?еди?е?а могу да садрже знатан бро? других елемента, ук?учу?у?и
водоник
,
азот
,
кисеоник
,
халогене
као и
фосфор
,
силици?ум
, и
сумпор
.
[2]
[3]
[4]
Органска ?еди?е?а
формира?у базу свих форми живота на
Зем?и
. Она су структурно веома разноврсна. Опсег примена органских ?еди?е?а ?е енорман. Она су било база, или важан конституент, многих производа, неки од ко?их су
пластика
,
лекови
,
петрохемикали?е
,
храна
,
експлозивни матери?али
, и
бо?е
.
Органска хеми?а ?е у почетку означавала део
хеми?е
ко?а се бавила систематиком хеми?ских ?еди?е?а, ко?а се како се веровало не могу добити путем синтезе у лаборатори?и, ?едино преко живих организама.
[5]
Фридрих Велер
, наставник сред?е техничке школе и доктор медицинских наука у Берлину, направио ?е
1828
. године прво синтетичко ?еди?е?е
карбамид
(органску матери?у ко?а се налази у
урину
). То ?е прва
синтетска
органска матери?а
произведена у лаборатори?и, т?. ван организма. Заним?иво ?е да ?е ова? наставник ову органску матери?у направио у намери да произведе неку другу
со
.
[6]
Касни?е се ипак показало, да се скоро сва органска ?еди?е?а могу вештачки добити. Доби?ено ?е и много ?еди?е?а ко?а се у природи не ?ав?а?у, али ко?а има?у сличне особине онима ко?и се налазе у живим организмима, као и онда ко?а се убра?а?у у органска а нису слична ?еди?е?има ко?а се налазе у живим организмима.
Са друге стране показало се да сва органска ?еди?е?а у себи садрже
уг?еник
ко?и ?е
четворовалентан
. Одатле потиче тренутна дефиници?а органске хеми?е да ?е она хеми?а уг?еникових ?еди?е?а. Изузетак представ?а?у
уг?ен-моноксид
,
уг?ен-диоксид
,
уг?ена киселина
и ?ене соли
карбонати
,
ци?аниди
,
метални карбонили
(ко?и спада?у у
координационе комплексе
) и
алотропске модификаци?е
уг?еника као што ?е
ди?амант
и
графит
ко?и се убра?а?у у неорганска ?еди?е?а.
Органска ?еди?е?а се често ?ав?а?у као
смеше
, те ?е стога разви?ен низ техника за одре?ива?е чисто?е. Ме?у ?има су посебно важне
хроматографске
технике:
HPLC
и
гасна хроматографи?а
. Традиционални методи сепараци?е обухвата?у
дестилаци?у
,
кристализаци?у
, и
екстракци?у растварачем
.
Органска ?еди?е?а су традиционално била карактерисана путем низ хеми?ских тестова, званих ?влажне методе“, али су такве анализе у знатно? мери заме?ене спектроскопским и другим рачунарски интензивним методама анализе.
[7]
Дати у приближном поретку знача?а, главни аналитички методи су:
- Спектроскопи?а нуклеарне магнетне резонанце (НМР)
?е на?шире кориш?ена техника. Она често омогу?ава комплетно одре?ива?е повезаности атома, па чак и
стереохеми?е
користе?и
корелациону спектроскопи?у
. Главни градивни атоми у органско? хеми?и - водоник и уг?еник - природно посто?е са НМР-одзивним
изотопима
1
H и
13
C.
- Елементална анализа
?е деструктивни метод ко?и се користи за одре?ива?е елементалне композици?е молекула.
- Масена спектрометри?а
да?е индикаци?у о
молекулско? маси
?еди?е?а. Подаци о структури се доби?а?у из анализе
образаца фрагментаци?е
. Масена спектроскопи?а високе резолуци?е може обично да идентифику?е тачну формулу ?еди?е?а и користи се као замена елементалне анализе. У прошлости ?е примена масене спектрометри?е била ограничена на неутралне молекуле ко?и су испар?иви, али ?е напредак ?онизационих техника омогу?ио доби?а?е масених спектра виртуално свих органских ?еди?е?а.
- Кристалографи?а
?е недвосмислен метод за одре?ива?а
молекуларне геометри?е
. Ограничава?у?е сво?ство ?е да кристал матери?ал мора да буде доступан, и да кристал мора да репрезентаци?а узорка. Високо аутоматизовани софтвер омогу?ава одре?ива?е структуре након неколико часова анализе дифракционог обрасца.
Традиционалне спектроскопске методе као што су
инфрацрвена спектроскопи?а
,
оптичка ротаци?а
и
УВ/ВИС спектроскопи?а
пружа?у релативно неспецифичне структурне информаци?е али оста?у у употреби за специфичне класе ?еди?е?а.
Типично су од интереса квалитативне и квантитативне физичке особине органских ?еди?е?а. Примери квантитативних информаци?а су тачка топ?е?а, тачка к?уча?а, и индекс рефракци?е. У квалитативне особине спада?у мирис, конзистенци?а, раствор?ивост, и бо?а.
У контрасту са ве?ином неорганских матери?ала, органска ?еди?е?а се типично топе и к?уча?у на умереним температурама. У прошлости су
тачка топ?е?а
и
к?уча?а
пружали пресудне информаци?е о чисто?и и идентитету органских ?еди?е?а. Тачке топ?е?а и к?уча?а су у корелаци?и са поларнош?у молекула и ?еговом молекулском масом. Нека органска ?еди?е?а, а посебно симетрична,
сублимира?у
, другим речима испарава?у без топ?е?а. Добро познат пример органског ?еди?е?а ко?е сублимира ?е
пара-дихлоробензен
, мирисни састо?ак модерних кугли против мо?аца. Органска ?еди?е?а обично нису веома стабилна на температурама изнад 300 °C, мада посто?е неки изузеци.
Неутрална органска ?еди?е?а су често
хидрофобна
, другим речима она су ма?е
растворна
у води него у органским растварачима. У изузетке спада?у органска ?еди?е?а ко?а садрже ?онизабилне групе као и
алкохоле
,
амине
, и
карбоксилне киселине
ниске молекулске масе код ко?их долази до
водоничног везива?а
. Органска ?еди?е?а су обично растворна у органским
растварачима
. Растварачи могу да буду било чисте супстанце попут
етра
и
етил алкохола
, или смеше, као што су парафински растварачи, нпр. разни
петролетри
и бензини, или опсег чистих или помешаних ароматичних растварача доби?ених из
нафте
или катранских фракци?а путем физичке сепараци?е или хеми?ске конверзи?е. Раствор?ивост у различитим растварачима зависи од типа растварача и хеми?ске структуре органског ?еди?е?а.
Разна специ?ализована сво?ства
молекулских кристала
и
органских полимера
са
кон?угованим системима
су од интереса у зависности од примене, е. г. термо-механичке и електро-механичке као што ?е
пиезоелектрицитет
, електрична провод?ивост, и електро-оптичке особине.
 Различита имена и прикази ?едног органског ?еди?е?а
Различита имена и прикази ?едног органског ?еди?е?а
Имена органских ?еди?е?а су било системска, у ком случа?у логично следе из скупа правила, или несистемска, у ком случа?у проистичу из разних традици?а.
Систематска номенклатура
?е одре?ена спецификаци?ама дефинисаним од стране
ИУПАЦ
организаци?е. Систематска номенклатура почи?е са именом
родите?ске структуре
унутар молекула од интереса. То родите?ско име се затим модифику?е префиксима, суфиксима, и бро?евима тако да недвосмислено одражава структуру. Има?у?и на уму да су десетине милиона органских ?еди?е?а познате, ригорозна употреба систематских имена може да буде незграпна. Стога се ИУПАЦ препоруке дословно следе за ?едноставни?а ?еди?е?а, а у ма?о? мери за комплексне молекуле. Да би се написало систематско име, структура ?еди?е?а мора бити позната, као и имена родите?ских структура. Родите?ске структуре обухвата?у несупституисане
уг?оводонике
,
хетероциклична ?еди?е?а
, и ?ихове монофункционализоване деривате.
Несистематска номенклатура ?е ?едноставни?а и недвосмислени?а. Несистематска имена не садрже индикаци?е од структури ?еди?е?а. Она се често користе за именова?е комплексних молекула, што обухвата ве?ину природних производа. На пример, неформално именовани
диетиламид лизергинске киселине
има систематско име: (6a
R
,9
R
)-
N
,
N
-диетил-7-метил-4,6,6a,7,8,9-хексахидроиндоло-[4,3-
fg
] хинолин-9-карбоксамид.
Са пове?аном применом рачунара, други методи именова?а су еволуирали с ци?ем ефикасне интерпретаци?е од стране машина. Два популарна формата су:
SMILES
и
InChI
.
Органски молекули се обично опису?у путем цртежа или
структурних формула
, комбинаци?а цртежа и хеми?ских симбола.
Скелетална формула
?е ?едноставна и недвосмислена. У овом систему, кра??е тачке и пресеци сваке лини?е представ?а?у уг?еник, док се атоми водоника било експлицитно пишу, или се ?ихово присуство имплицитно претпостав?а из тетравалентности уг?еника. Опис органских ?еди?е?а помо?у цртежа ?е знатно по?едностав?ен чи?еницом да уг?еник у скоро свим органским ?еди?е?има има четири везе, азот три, кисеоник две, и водоник ?едну.
Класификаци?а органских ?еди?е?а
[
уреди
|
уреди извор
]
 Фамили?а
карбоксилних
киселина садржи карбоксилну (-COOH)
функционалну групу
.
Сир?етна киселина
?е пример ?еди?е?а из ове фамили?е.
Фамили?а
карбоксилних
киселина садржи карбоксилну (-COOH)
функционалну групу
.
Сир?етна киселина
?е пример ?еди?е?а из ове фамили?е.
Концепт
функционалних група
?е централан у органско? хеми?и као начин класификаци?е структура и вид предви?а?а особина. Функционална група ?е део молекула, и реактивност функционалне групе се подразумева да ?е слична за ве?ину молекула. Функционалне групе могу да има?у одлучну улогу у хеми?ским и физичким сво?ствима ?еди?е?а. Молекули се класифику?у на бази ?ихових функционалних група. Алкохоли, на пример има?у под?единицу C-O-H. Сви алкохоли су донекле
хидрофилни
, обично формира?у
естре
, и могу да се конверту?у до одговара?у?их
халида
. Ве?ина функционалних група садржи хетероатоме (атоме осим C и H).
Примери функционалних група:
Алифатични уг?оводоници се деле у три групе
хомологних редова
на основу ?иховог степена
заси?ености
:
- парафини или
алкани
су уг?оводоници без двоструки или
троструких веза
- олефини или
алкени
садрже ?едну или више двоструких веза, нпр. диолефини (диени) или полиолефини
- алкини
садрже ?едну или више троструке везе.
Остатак групе се класифику?е на основу функционалних група. Таква ?еди?е?а могу да има?у прав ланац, разгранат ланац или да буду циклична. Степен грана?а утиче на сво?ства ?еди?е?а, као што ?е
октански бро?
или
цетански бро?
у хеми?и нафте.
Циклична ?еди?е?а могу да буду заси?ена и незаси?ена. На?стабилни?и прстени садрже пет или шест атома уг?еника, мада су велики прстени (макроциклична ?еди?е?а) и ма?и прстени често сре?у. На?ма?а циклоалканска фамили?а ?е трочлани
циклопропан
((CH
2
)
3
). Заси?ена циклична ?еди?е?а (
циклоалкани
) садрже само ?едноструке везе.
Циклоалкени
и
циклоалкини
садрже двоструке и троструке везе.
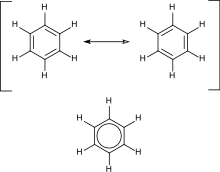 Бензен
?е ?едно од на?познати?их ароматичних ?еди?е?а. Он ?е ме?у на??едноставни?им и на?стабилни?им ароматицима.
Бензен
?е ?едно од на?познати?их ароматичних ?еди?е?а. Он ?е ме?у на??едноставни?им и на?стабилни?им ароматицима.
Ароматични
уг?оводоници садрже
кон?уговане
двоструке везе. На?важни?и пример ?е
бензен
. ?егову структуру ?е формулисао
Кекуле
ко?и ?е први предложио принцип
делокализаци?е
или
резонанци?е
ради об?аш?ава?а структуре. За ?конвенционална“ циклична ?еди?е?а, ароматичност ?е одре?ена присуством 4n + 2 делокализована пи електрона, где ?е n cео бро?. Посебну нестабилност (
антиароматичност
) манифесту?у ?еди?е?а са 4n кон?угована пи електрона.
Карактеристике цикличних уг?оводоника се знатно разлику?у ако су присутни хетероатоми, ко?и могу да посто?е било као супституенти везани спо?а за прстен или као чланови самих прстена. У касни?ем случа?у прстен се назива
хетероцикличним
.
Пиридин
и
фуран
су примери ароматичних хетероцикличних ?еди?е?а, док су
пиперидин
и
тетрахидрофуран
одговара?у?и алициклични прстени. Хетероатом хетероцикличних молекула ?е генерално кисеоник, сумпор, или азот. Азот ?е посебно чест у биохеми?ским системима.
Примери група ме?у хетероцикличним прстеновима су анилинске бо?е, ве?ина ?еди?е?а ко?има се бави биохеми?а, нпр.
алкалоиди
, многа ?еди?е?а везана за
витамине
,
стероиде
,
нуклеинске киселине
(нпр.
ДНК
,
РНК
), као и бро?ни
лекови
. Примери хетероцикличних ?еди?е?а са релативно ?едноставним структурама су
пирол
и
индол
.
Прстени могу да буду ме?усобно кондензовани у
полициклична ?еди?е?а
.
Пуринске
нуклеозидне базе су пример полицикличних ароматичних хетеропрстена. Прстени могу да буду кондензовани на уг?у тако да ?едан атом има две веза у ?едном прстену и две везе у другом. То су
спиро
?еди?е?а. Она су важна у бро?ним природним производима.
?едно важно сво?ство уг?еника ?е да лако формира ланце или мреже, ко?е су повезане везама изме?у уг?еника. Процес повезива?а се назива
полимеризаци?а
, док су ланци
полимери
. Повезане молекулске ?единице су
мономери
.
Посто?е две главне групе полимера: синтетички полимери и
биополимери
. Синтетички полимери се производе вештачки, и назива?у се
индустри?ским полимерима
.
[8]
Биополимери се ?ав?а?у у природи, или без ?удске интервенци?е.
 Ма?итотоксин
, комплексни органски биолошки токсин.
Ма?итотоксин
, комплексни органски биолошки токсин.
Биомолекулска хеми?а
?е ?една од главних категори?а у органско? хеми?и ко?у често изучава?у
биохемичари
. Многе комплексне мултифункционалне групе молекула су важне за живе организме. Неке су дуголанчани биополимери, у ко?е се убра?а?у
пептиди
,
ДНК
,
РНК
и
полисахариди
попут
скроба
и
целулозе
. Друга знача?на класа су
аминокиселине
(мономерни градивни блокови пептида и
протеина
),
уг?ени хидрати
(ко?и обухвата?у полисахариде),
нуклеинске киселине
(од ко?их се формира?у ДНК и РНА), и
липиди
. Поред тога, животи?ска биохеми?а садржи многе мале молекуле ко?и помажу у продукци?и енерги?е путем
Кребсовог циклуса
, као и формира?у
изопрена
, на?распростра?ени?ег уг?оводоника у животи?ама. Изопрени у животи?ама формира?у структурне
стероиде
(
холестерол
) и
стероидне хормоне
. Из изопрена се у би?кама формира?у
терпени
,
терпеноиди
, по?едини
алкалоиди
, и ?единствена група уг?оводоника званих биополимерни полиизопреноиди. Они су присутни у
латексном
соку, ко?и ?е база за прав?е?е
гуме
.
У фармакологи?и су
мали молекули
важна група органских ?еди?е?а. Они се тако?е назива?у
мала органска ?еди?е?а
. У том контексту, а мали молекул ?е мало органско ?еди?е?е ко?е ?е биолошки активно, али ни?е
полимер
. У пракси, мали молекули има?у
моларну масу
ма?у од око 1000 g/mol.
 Молекулски модел
кофеина
.
Молекулски модел
кофеина
.
Фулерени
и
уг?еничне наноцеви
су ?еди?е?а уг?еника са сфероидним и цевастим структурама. Та ?еди?е?а су знача?на за
науку о матери?алима
.
Органска ?еди?е?а ко?а садрже уг?еник везан за азот, кисеоник и
халогене
се нормално засебно групишу. Друга ?еди?е?а се понекад став?а?у у подгрупе и разматра?у као
органосумпорна хеми?а
,
органометална хеми?а
,
органофосфорна хеми?а
и
органосиликонска хеми?а
.
Ве?ина молекула ?е стабилна. Боце
воде
,
ацетона
или
метил ?одида
се могу чувати годинама без промена хеми?ске композици?е молекула. Ме?утим када се дода?у хеми?ски реагенси, нпр.
HCl
у воду,
натри?ум ци?анид
(NaCN) у ацетон, или
натри?ум хидроксид
у метил ?одид, долази до хеми?ских реакци?а.
Молекули реагу?у зато што се константно кре?у кроз простор судара?у?и се са другим молекулима и зидовима суда у коме се налазе, као и са
растварачем
, ако су у
раствору
.
Атоми
се исто тако кре?у унутар молекула, дужине ?ихових веза и углови изме?у веза осцилу?у, везе се сави?а?у. Кад ?е дужина везе у молекулу знатно пове?ана, она може да се прекине и при томе долази до хеми?ске реакци?е. Кад се два молекула сударе, они могу да се комбину?у формира?ем нове везе.
Сви органски молекули има?у спо?аш?и сло? са знатним бро?ем
електрона
, ко?и заузима?у попу?ене
орбитале
, везу?у?е и невезу?у?е. Одби?а?е наелектриса?а изме?у тих електрона осигурава да се молекули ме?усобно одби?а?у. До реакци?е долази ?едино ако молекули има?у дово?но енерги?е (
енерги?а активаци?е
) да над?ача?у одбо?не силе и при?у дово?но близу ?едан другог. Ако два молекула нема?у неопходну енерги?у активаци?е они се ?едноставно судара?у, одби?а?у, и разме?у?у енерги?у, али оста?у хеми?ски непроме?ени.
- Привлаче?е орбитала
Поред универзалне одбо?не силе, тако?е су важне силе привлаче?а изме?у молекула ако су наелектрисани.
Кат?они
и
ан?они
се ме?усобно електростатички привлаче и то привлаче?е ?е у неким случа?евима дово?но до до?е до реакци?е. Кад алкил хлорид (RCl) реагу?е са
натри?ум ?одидом
(NaI) у
ацетонском
(Me
2
C=O) раствору формира се преципитат
натри?ум хлорида
.
?они
натри?ума
(Na
+
) и
хлорида
(Cl
-
) се привлаче у раствору и формира?у
кристалну решетку
од наизменичних кат?она и ан?она - талог кристалног натри?ум хлорида.
Неоргански стил привлаче?а ?е редак у органским реакци?ама. Знатно чеш?и узрок органских реакци?а ?е привлаче?е изме?у наелектрисаног реагенса (кат?она или ан?она) и органског ?еди?е?а ко?е има
дипол
. Пример такве реакци?е ?е реакци?а изме?у
натри?ум ци?анида
(соли NaCN) и
карбонилног
?еди?е?а попут ацетона. Натри?ум ци?анид се у раствору састо?и од кат?она натри?ума (Na
+
) и ци?анатних ан?она (CN
-
). Ацетон има карбонилну групу, C=O двоструку везу, ко?а ?е поларизована ?ер ?е кисеоник
електронегативни?и
од уг?еника. Негативни ци?анидни ?он привлачи позитивни кра? карбонилне групе дипола. Ни?е увек неопходно да реагенс буде наелектрисан.
Амони?ак
тако?е реагу?е са ацетоном и у овом случа?у
слободни електронски пар
- пар ко?и не учеству?е у везива?е и ко?и ?е концентрисан на атому азота ненаелектрисаног молекула амони?ака - ?е привучен позитивним кра?ем карбонилног дипола.
Поларност може да проистекне и из
σ веза
. На?електронегативни?и елемент
периодног система
?е
флуор
и три атома флуора на електропозитивном
бору
производе парци?ално позитивно наелектрисани атом бора путем поларизаци?е σ везе. Негативни кра? ацетонског дипола (атом кисеоника) привлачи атом бора у BF
3
. Бор ?е у
III групи
периодног система и стога има шест електрона око себе у сво?им тровалентним ?еди?е?има. Празна орбитала атома не одби?а електронима богате области других молекула, тако да атом кисеоника ацетон електростатички привучен ка парци?ално позитивном наелектриса?у и ?едан од слободних електронских парова кисеоника може да формира везу?у?у интеракци?у са празном орбиталом.
- Преклапа?е орбитала
Друге органске реакци?е се одви?а?у изме?у потпуно ненаелектрисаних молекула ко?и нема?у диполе. ?едан од старих тестова за незаси?еност ?е третира?е ?еди?е?а
бромираном
(Br
2
) водом. Ако нестане сме?е бо?е, молекул ?е незаси?ен. Разво? спектроскопи?е ?е учинио такве тестове застарелим, али ?е реакци?а ?ош увек важна. ?едноставни симетрични
алкен
се комбину?е са симетричним бромом у ?едноставно?
реакци?и адици?е
. ?едини електрони ко?и могу да буду корисни у молекулском привлаче?у су слободни електрони брома. Привлаче?е изме?у молекула ни?е електростатичко. До реакци?е долази ?ер молекул брома има слободну орбиталу ко?а може да прими електроне. То ни?е локализована атомска орбитала попут оне у BF
3
молекулу. То ?е
антивезу?у?а орбитала
ко?а припада Br-Br σ вези. У овом случа?у посто?и привлаче?е изме?у пуне орбитале (
π везе
) и празне орбитале (σ
*
орбитале Br-Br везе). Молекули се ме?усобно привлаче због ове интеракци?е празне и пуне орбитале, и то доводи до везива?а, за разлику од свих других одбо?них интеракци?а изме?у попу?ених орбитала.
Многе органске реакци?е су последица интеракци?а пуних и празних орбитала. Многе тако?е обухвата?у интеракци?е наелектриса?а. Независно од типа привлаче?а изме?у органских молекула, у реакци?ама долази до крета?а електрона, ко?и се кре?у са ?едног места на друго. Дета?и тог процеса се назива?у
механизмом реакци?е
.
- Проток електрона
Ве?ина органских реакци?а су поларне природе. Електрони прелазе са ?едног молекула на други током реакци?е. Електронски донор се назива
нуклеофил
, док ?е акцептор електрона
електрофил
. Ти термини произилазе из иде?е да ?е привлаче?е наелектриса?а доминира?у?а сила у реакци?ама. Нуклеофили не реагу?у са
нуклеусом
, него са празним електронским орбиталама. Упркос томе, електростатичко привлаче?е и одби?а?е могу да има?у пресудну улогу у одре?ива?у тока процеса. Ако молекул има позитивно наелектриса?е, то ?е због тога што има више протона у ?езгрима него електрона око ?их.
- ^
Morrison Robert Thornton; Boyd Robert Neilson (2006).
Organic chemistry
. Engelwood Cliffs, New Jersey: Prentice Hall.
ISBN
8120307658
.
- ^
Roberts, John D.; Caserio, Marjorie C. (1964).
Basic Principles of Organic Chemistry
. W. A. Benjamin, Inc.
- ^
Richard F. & Daley, Sally J.
Organic Chemistry, Online organic chemistry textbook
.
- ^
Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001).
Organic Chemistry
(I изд.). Oxford University Press.
ISBN
978-0-19-850346-0
.
- ^
Friedrich Wohler (1828).
?Ueber kunstliche Bildung des Harnstoffs”
.
Annalen der Physik und Chemie
.
88
(2): 253?256.
Bibcode
:
1828AnP....88..253W
.
doi
:
10.1002/andp.18280880206
.
Available in English at:
Chem Team
- ^
R.L. Shriner; C.K.F. Hermann; T.C. Morrill; D.Y. Curtin & R.C. Fuson John (1997).
The Systematic Identification of Organic Compounds
. Wiley & Sons.
ISBN
978-0-471-59748-3
.
- ^
"Industrial polymers, chemistry of."
Encyclopædia Britannica
. 2006
|
|---|
| Ме?ународне
| |
|---|
| Државне
| |
|---|
| Остале
| |
|---|