| 二酸化硫?
|

|

|

|
|
|
| 識別情報
|
| CAS登?番?
|
7446-09-5
|
| ChemSpider
|
1087
|
| EC番?
|
231-195-2
|
| E番?
|
E220
(防腐?)
|
| ?連/北米番?
|
1079, 2037
|
| RTECS
番?
|
WS4550000
|
|
|
InChI=1S/O2S/c1-3-2
Key: RAHZWNYVWXNFOC-UHFFFAOYSA-N
|
| 特性
|
| 化?式
|
SO
2
|
| モル質量
|
64.07 g mol
-1
|
| 外?
|
無色??
|
| 密度
|
- 2.551 g/L
[
要出典
]
, ??
- 1.354 g/cm
3
(-30 ℃)
[
要出典
]
, 液?
- 1.434 g/cm
3
(-10 ℃)
[1]
, 液?
|
| 融点
|
-72.4 ℃ (200.75 K)
[
要出典
]
|
| 沸点
|
-10 ℃ (263 K)
[1]
|
| 水
への
溶解度
|
9.4 g/100 mL (25 ℃)
|
| 蒸??
|
- -10 ℃ : 1013 hPa
- 20 ℃ : 3300 hPa
- 40 ℃ : 4400 hPa
|
| 酸解離定?
p
K
a
|
1.81
|
| 構造
|
| 分子の形
|
折れ線形
(O-S-O 結合角は120度)
[2]
|
| ?極子モ?メント
|
1.63
D
|
| 危?性
|
| GHSピクトグラム
|
 
|
| GHSシグナルワ?ド
|
警告(WARNING)
|
| Hフレ?ズ
|
H314
,
H331
|
| Pフレ?ズ
|
P260
,
P261
,
P264
,
P271
,
P280
,
P301+330+331
,
P303+361+353
,
P304+340
,
P305+351+338
,
P310
,
P311
,
P321
,
P363
,
P403+233
|
| NFPA 704
|
|
| 引火点
|
不燃性
|
| ?連する物質
|
| ?連物質
|
|
| 特記なき場合、デ?タは
常?
(25
°C
)?
常?
(100 kPa) におけるものである。
|
二酸化硫?
(にさんかいおう、
英
:
sulfur dioxide
)は、化?式SO
2
の
無機化合物
である。常?では
刺激臭
を有する
??
。??は別名
?硫酸ガス
[3]
。
化石燃料
の
燃?
などで大量に排出される
硫?酸化物
の一種であり、きちんとした?理を行わない
排出ガス
は
大?汚染
や
環境問題
の一因となる。
二酸化硫?は
火山活動
や
工業
活動により産出される。
石炭
や
石油
は多量の
硫?
化合物を含んでおり、この硫?化合物が
燃?
することで?生する。また、火山活動でも?生する。二酸化硫?は
二酸化窒素
などの存在下で
酸化
され
硫酸
となり、
酸性雨
の原因となる
[4]
。空?よりも重い。
合成
[
編集
]
二酸化硫?は硫?の
完全燃?
により?生する。

硫化水素
や他の
有機硫?化合物
の燃?においても似たような反?が進行し、二酸化硫?が?生する。

???
や
閃?鉛?
、
辰砂?石
などの
硫化?
の加熱によっても?生する。



セメント
製造の際には、無水
硫酸カルシウム
を
コ?クス
と加熱し
ケイ酸カルシウム
を生産するが、二酸化硫?が副生成物として?生する。

熱濃硫酸と
銅
とを反?させると、二酸化硫?を?生させることができる。

この他にも
チオ硫酸ナトリウム
と
酸
の反?、
?硫酸ナトリウム
と
硫酸
の反?、
?硫酸水素ナトリウム
の
熱分解
などによっても?生する。
反?
[
編集
]
水
と反?し、
?硫酸
を生成する。

二酸化窒素
との
酸化還元
反?により、
一酸化窒素
と
三酸化硫?
が生成する。

過酸化水素
との反?では
硫酸
が生成する。

構造
[
編集
]
 二酸化硫?の構造
二酸化硫?の構造
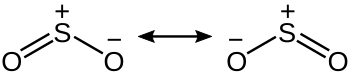 二酸化硫?の2つの
共鳴構造
二酸化硫?の2つの
共鳴構造
二酸化硫?は
C
2v
??
の
折れ線形
構造である。
電子
に着目すると、硫?原子の
形式酸化?
は+4、
電荷
は0で、5つの
電子?
を持っている。
分子軌道法
の点から見ると多くの電子?が結合に??しており、典型的な
超原子?化合物
であると言われていたが、?際にはオゾン類似の比較的?純な結合構造であることが判明している。
硫?酸化物
の
一酸化硫?
と二酸化硫?のS-O結合長は、一酸化硫?SO (148.1 pm)、二酸化硫?SO
2
(143.1 pm) とOの?が?えるにつれて短くなっているが、酸素の
同素?
の
二酸素
と
オゾン
のO-O結合長は、二酸素O
2
(120.7 pm)、オゾンO
3
(127.8 pm) と長くなっている。さらに、
結合解離エネルギ?
が一酸化硫?と二酸化硫?ではSO (524 kJ mol
-1
)、SO
2
(548 kJ mol
-1
) と大きくなっているのに?し、二酸素とオゾンではO
2
(490 kJ mol
-1
)、O
3
(297 kJ mol
-1
) と小さくなっている。これに?しては、オゾンの各O-O結合が1.5重結合
[5]
であるのに?し、二酸化硫?の場合は
d軌道
の混成による超原子?構造によりS=O二重結合となっている??であると?明された時代もあった(現在でもその誤った?明がなされている書籍などもある)。しかしながら硫?を含む超原子?化合物(と呼ばれていた分子)の場合、理論計算(
自然結合軌道
を用いる)ではd軌道の結合への寄?は無視出?る程度に小さいことが少なくとも1980年代には判明しており
[6]
[7]
[8]
[9]
[10]
、この解?が誤りなのは明らかである。つまり、硫?原子の3d軌道は結合に??するにはエネルギ?的に高すぎであり
[11]
、2本のS-O
σ結合
とO-S-O鎖を?ぐ
三中心四電子
π結合
からなるルイス構造が最適な描?である(この結果S-O結合の
結合次?
は1.5となる)
[5]
。近年の??により、二酸化硫?のS-O結合はオゾンと同じように1.5重結合であるが、電?陰性度の違いにより硫?原子が+2?、酸素原子が-1に近くなる事による?者の間のイオン結合的な力が?き、これが加算されることで2重結合なみの結合エネルギ?となっている事が判明している
[12]
[13]
[14]
。
用途
[
編集
]
 | この節は
??可能
な
?考文?や出典
が全く示されていないか、不十分です。
出典を追加
して記事の信?性向上にご協力ください。
(
このテンプレ?トの使い方
)
出典?索
?
:
"二酸化硫?"
?
ニュ?ス
·
書籍
·
スカラ?
·
CiNii
·
J-STAGE
·
NDL
·
dlib.jp
·
ジャパンサ?チ
·
TWL
(
2020年5月
)
|
二酸化硫?には抗菌作用があるため、
食品添加物
として
酒
や
ドライフル?ツ
の
保存料
、
漂白?
、
酸化防止?
に使われている。
腐敗
を防ぐためというより、見た目を保つために用いられることが多い。ドライフル?ツは?特の風味を持つが、二酸化硫?もその一因となっている。
ワイン
製造にも重要な役割を果たしており、ワイン中にもppm?位で存在している。
抗菌?
や酸化防止?の役割を果たし、?菌の繁殖や酸化を防ぎ、
酸性度
を一定に保つ手助けをしている。
二酸化硫?は
還元?
としても用いられる。水の存在下で還元的な?色作用を示すため、紙や衣服などの
漂白?
として用いられる。しかし空?中の
酸素
により再酸化が起こるため、この漂白作用は長くは?かない。
二酸化硫?は硫酸の生産にも用いられる。この場合二酸化硫?の酸化により
三酸化硫?
を合成し、ここから硫酸が合成される。この方法は
接?法
として知られている。
クロ?ド?リブ
(
Claude Ribbe
) の『ナポレオンの犯罪
The Crime of Napoleon
』によると、二酸化硫?は19世紀の初めまで、フランス皇帝により
ハイチ
の奴隷の反?の??に用いられていた。
二酸化硫?は
肺
の伸縮に?する受容?の信?を止め、
ヘ?リング?ブロイエル反射
を止める。
フロン
の開?に先立ち、二酸化硫?は家庭用
冷?庫
の
冷媒
に用いられていた。
昆?の標本を作る際、
酢酸エチル
を使うと?毛がぬれたり?色が?化したり油が染みでたりすることのある昆?の
殺??
として用いられている。
排出量
[
編集
]
人?的なもの
[
編集
]
アメリカ合衆?
の
EPA
が
2002年
に報告したデ?タ
[15]
によると、アメリカ合衆?の二酸化硫?排出量の?遷は以下のようになっている(?位:
S/T
)。
| 年
|
排出量
|
| 1970年
|
31,161
|
| 1980年
|
25,905
|
| 1990年
|
23,678
|
| 1996年
|
18,859
|
| 1997年
|
19,363
|
| 1998年
|
19,491
|
| 1999年
|
18,867
|
主にEPAの酸性雨?策プログラムの主導により、アメリカ合衆?の二酸化硫?排出量は
1983年
から2002年の間で約33%減少した。これは排?ガスの
?硫技術
が進み、硫?を含む燃料を燃?させても硫?酸化物を回?できるようになったためである。特に
酸化カルシウム
は二酸化硫?と反?し、
?硫酸カルシウム
になることで二酸化硫?を吸着する。

2006年
現在、
中華人民共和?
が世界で最も二酸化硫?を排出している?である。
2005年
の排出量は2549万トンであった。この排出量を
2000年
のものと比較すると約27%?加しており、アメリカ合衆?の
1980年
の排出量に相?する。
自然?生的なもの
[
編集
]
火山
自?や
噴火
の規模にもよるが、
火口
などからは相?量の二酸化硫?が放出される。日本の
?島
は、
2011年
12月に125回も爆?的な噴火を記?する活?な時期を迎えていたが、この際に?測された平均放出量は日量1,800tから2,900tと推計されている
[16]
。
1991年
に?生した
フィリピン
の
ピナツボ山
の噴火では1500万から2千万トンの二酸化硫?が放出された。成層?に達した二酸化硫?は硫酸エアロゾルを形成し、長期間にわたり地表の日射量を減少させ穀物の?穫量に影響を?える(例:
夏のない年
、
1993年米?動
)こともある。影響が出始める量は500万トン以上と推計されている
[17]
。
水への溶解度の?度依存性
[
編集
]
| ?度
|
溶解度
|
| 0 ℃
|
22 g/100ml
|
| 10 ℃
|
15 g/100ml
|
| 20 ℃
|
11 g/100ml
|
| 25 ℃
|
9.4 g/100ml
|
| 30 ℃
|
8 g/100ml
|
| 40 ℃
|
6.5 g/100ml
|
| 50 ℃
|
5 g/100ml
|
| 60 ℃
|
4 g/100ml
|
| 70 ℃
|
3.5 g/100ml
|
| 80 ℃
|
3.4 g/100ml
|
| 90 ℃
|
3.5 g/100ml
|
| 100 ℃
|
3.7 g/100ml
|
毒性
[
編集
]
二酸化硫?は
呼吸器
を刺激し、
せき
、
?管支喘息
、
?管支炎
などの障害を引き起こす
[18]
。
0.5
ppm
以上でにおいを感じ、30-40 ppm 以上で呼吸困難を引き起こし、100 ppm の濃度下に50?70分以上留まると危?。400 ppm 以上の場合、?分で生命に危?が及ぶ。500 ppm を超えると嗅?が冒され、むしろ臭?を感じなくなる。高濃度の地域に短時間いるよりも、低濃度地域に長時間いる場合の被害のほうが多い。
代表的な例として、日本における第二次世界大?後の
四大公害事件
とされ、1961年頃より?生した
四日市ぜんそく
があげられる。
1960
?
70年
代に高濃度の汚染を日本各地に引き起こしたが、工場等の
固定?生源
や
石油
の使用による?生も
?硫?置
により?策が進められた結果、汚染が改善された。また
足尾銅山?毒事件
も有名である。海外では1952年に?週間で一万人以上が死亡した
ロンドンスモッグ
がある。
19世紀半ばの
クリミア??
では
セバスト?ポリ
の?いで
イギリス軍
が
化?兵器
として使用したのではないかとも言われている。
2007年現在、日本では二酸化硫?の
環境基準
は
1時間値
の1日平均が 0.04 ppm 以下であり、かつ1時間値が 0.1 ppm 以下であることとされている。
?考文?
[
編集
]
- ^
a
b
“
3.2 Properties of inorganic compounds ; Part 4: Silicon - Zirconium
” (英語).
Kaye and Laby Online (based on 16th edition (published 1995))
.
イギリス?立物理??究所
(1995年). 2017年6月20日時点の
オリジナル
よりア?カイブ。
2022年1月18日
??。
- ^
Table of Geometries based on VSEPR
- ^
"二酸化イオウ".
岩波理化??典
(第3版?補版第3刷 ed.). 岩波書店. 5 November 1982. p. 974.
- ^
Dr. Mike Thompson, Winchester College, UK
http://www.chm.bris.ac.uk/motm/so2/so2h.htm
- ^
a
b
グリ?ンウッド, ノ?マン
; ア?ンショウ, アラン (1997).
Chemistry of the Elements
(英語) (2nd ed.).
バタ?ワ?ス=ハイネマン
(
英語版
)
.
ISBN
978-0-08-037941-8
。
p. 700
- ^
Kutzelnigg, W. (1984). “Chemical Bonding in Higher Main Group Elements”.
Angew. Chem. Int. Ed.
23
: 272-295.
doi
:
10.1002/anie.198402721
.
- ^
Reed, A. E.; Weinhold, F. (1986). “On the role of d orbitals in sulfur hexafluoride”.
J. Am. Chem. Soc.
108
: 3586-3593.
doi
:
10.1021/ja00273a006
.
- ^
Mezey, P. G.; Haas, E. C. (1982). “The propagation of basis set error and geometry optimization in ab initio calculations. A statistical analysis of the sulfur d?orbital problem”.
J. Chem. Phys.
77
: 870.
doi
:
10.1063/1.443903
.
- ^
Gilheany, D. G. (1994). “Ylides, phosphoniumNo d Orbitals but Walsh Diagrams and Maybe Banana Bonds: Chemical Bonding in Phosphines, Phosphine Oxides, and Phosphonium Ylides”.
Chem. Rev.
94
: 1339-1374.
doi
:
10.1021/cr00029a008
.
- ^
Dobado, J. A.; Martinez-Garcia, H.; Molina, J. M.; Sundberg, M. R. (2000). “Chemical Bonding in Hypervalent Molecules Revised. 3. Application of the Atoms in Molecules Theory to Y
3
X-CH
2
(X = N, P, or As; Y = H or F) and H
2
X-CH
2
(X = O, S, or Se) Ylides”.
J. Am. Chem. Soc.
122
: 1144-1149.
doi
:
10.1021/ja992672z
.
- ^
Stefan, T.; Janoschek, R. (2000). “How relevant are S=O and P=O Double Bonds for the Description of the Acid Molecules H
2
SO
3
, H
2
SO
4
, and H
3
PO
4
, respectively?”.
J. Mol. Model.
6
(2): 282-288.
doi
:
10.1007/PL00010730
.
- ^
Powers, D.; Olson, H. G. (1980). “Determination of S-O bond order in sulfur dioxide and dimethyl sulfite using a low?energy particle?accelerator technique”.
J. Chem. Phys.
73
: 2271.
doi
:
10.1063/1.440376
.
- ^
Jurgensen, A.; Cavell, R. G. (2000). “A comparison of the oxygen 1s photoabsorption spectra of SO
2
and NO
2
”.
Chem. Phys.
257
: 123.
doi
:
10.1016/S0301-0104(00)00147-6
.
- ^
Grabowsky, S.; Luger, P.; Buschmann, J.; Schneider, T.; Schirmeister, T.; Sobolev, A. N.; Jayatilaka, D. (2012). “The Significance of Ionic Bonding in Sulfur Dioxide: Bond Orders from X-ray Diffraction Data”.
Angew. Chem. Int. Ed.
51
: 6776-6779.
doi
:
10.1002/anie.201200745
.
- ^
“
ア?カイブされたコピ?
”. 2008年12月25日時点の
オリジナル
よりア?カイブ。
2008年12月18日
??。
- ^
?島の火山活動解?資料(平成22年1月)
福岡管??象台火山監視?情報センタ?,鹿?島地方?象台
- ^
“
トンガ噴火は日本に「令和の米?動」引き起こすか? 米?授が指摘する“?倒的に少ない”物質とは
”. AERA.com (2022年1月20日).
2022年1月24日
??。
- ^
大?中の二酸化硫?(SO2),浜松市
?連項目
[
編集
]
外部リンク
[
編集
]