 Tetrapeptido
Val
-
Gly
-
Ser
-
Ala
.
Tetrapeptido
Val
-
Gly
-
Ser
-
Ala
.
Os
peptidos
son un tipo de
moleculas
formadas pola union de varios
aminoacidos
mediante
ligazons peptidicas
.
Os peptidos, do mesmo xeito que as
proteinas
, estan presentes na natureza e son responsables dun gran numero de funcions, moitas das cales ainda non se conecen.
A union dun baixo numero de
aminoacidos
da lugar a un peptido. Unha clasificacion tradicional das cadeas peptidicas polo seu tamano e a seguinte:
- Oligopeptido
: menos de 10 aminoacidos. Poden ser
dipeptidos
, tripeptidos, tetrapeptidos... segundo tenan dous, tres, catro... aminoacidos, respectivamente.
- Polipeptido
: mais de 10 aminoacidos.
- Proteina
: mais de 100 aminoacidos. As
proteinas
cunha soa cadea polipeptidica denominanse
proteinas monomericas
, mentres que as compostas de mais dunha cadea polipeptidica conecense como
proteinas
multimericas
.
Os peptidos diferencianse das
proteinas
en que son mais pequenos (tenen menos de dez mil ou doce mil
daltons
) e en que as proteinas poden estar formadas pola union de varios polipeptidos e as veces
grupos prosteticos
. Poren, a distincion entre polipeptidos e proteinas e un tanto arbitraria e variable na literatura cientifica, xa que alguns autores ponen outros limites no numero de aminoacidos (menos de 100), e non e definitivo tampouco o criterio estrutural. Non esta claro o limite entre os polipeptidos grandes e as proteinas pequenas. Alguns autores usan os termos
cadea polipeptidica
e mesmo "polipeptido" co significado de cadea simple de aminoacidos independentemente do seu tamano. Un exemplo de polipeptido e a
insulina
, composta de 55 aminoacidos e conecida como unha
hormona
de acordo a funcion que ten no organismo dos seres humanos. Entre os peptidos pequenos son exemplos o tripeptido
glutation
e a hormona
oxitocina
, de nove aminoacidos.
As
peptonas
son derivados do leite ou de carne dixerida por
proteolise
.
[
1
]
Ademais de conteren pequenos peptidos, o material resultante inclue graxas, metais, sales,
vitaminas
e moitos outros compostos bioloxicos. As peptonas son utilizadas como
medios nutrientes
para o crecemento de
bacterias
e
fungos
.
[
2
]
Comportamento acido/base dos peptidos
[
editar
|
editar a fonte
]
Posto que tenen un grupo
amino terminal
e un
carboxilo terminal
; e poden ter grupos R ionizables, os peptidos tenen un comportamento acido/basico similar ao dos aminoacidos.
Os peptidos, do mesmo xeito que
aminoacidos
e
proteinas
son
biomoleculas
cun caracter
anfotero
que permiten a regulacion
homeostatica
dos organismos.
E de destacar este comportamento nas
encimas
, peptidos que funcionan como catalizadores bioloxicos das reaccions metabolicas, xa que tenen unha valencia de actuacion dentro de certos niveis de pH. En caso de superarse producese unha descompensacion de cargas na superficie da encima, que perde a sua estrutura e a sua funcion
Son as mesmas que para os aminoacidos; e dicir, as que dea o seu
grupo amino
,
carboxilo
e R.
Estas reaccions (sobre todo as do os grupos amino e carboxilo) empregaronse para secuenciar peptidos.
En canto as reaccions do grupo
amino
, e moi interesante a reaccion co
reactivo de Sanger
para secuenciar, xa que se temos o 2,4-dinitrofenil-peptido e o hidrolizamos por hidrolise aceda, se hidrolizaran todas as ligazons peptidicos e obteremos o dinitrofenil do primeiro aminoacido da secuencia, o NH
2
terminal, mais o resto dos aminoacidos disgregados no medio.
Con esta reaccion Sanger conseguiu secuenciar a
insulina
.
Nesta reaccion, o nucleo coloreado de dinitrobenceno unese ao atomo de nitroxeno do aminoacido para producir un derivado amarelo, o derivado 2,4-dinitrofenil ou DNP-aminoacido. O composto DNFB reaccionase co grupo amino libre do extremo amino dun polipeptido, asi como tamen cos grupos amino dos aminoacidos libres. A ligazon C ? N que se forma e polo xeral moito mais estable que unha ligazon peptidica. Desta forma, facendo reaccionar unha proteina nativa ou un polipeptido intacto co DNFB, hidrolizando a proteina en acido e illando os DNP-aminoacidos coloreados, pode identificarse o grupo amino terminal do aminoacido nunha cadea polipeptidica. O grupo amino terminal da lisina e alguns outros
grupos funcionais
das cadeas laterais tamen reaccionasen co DNFB.
Con todo, despois da
hidrolise
, so o derivado do grupo amino terminal do aminoacido orixinal tera o seu grupo α-amino bloqueado; asi mesmo, tales DNP-α-aminoacidos poden separarse doutros derivados DNP mediante procedementos de extraccion simples. Con calquera dos variados metodos
cromatograficos
poderase identificar aos DNP-α-aminoacidos

Pero este proceso consome moita enerxia, xa que, tendo o primeiro aminoacido hai que obter os demais rompendo por outras zonas. Isto evitase co
procedemento de Edman
(tamen e unha reaccion de aminoacidos): Como a ciclacion se da en condicions acedas suaves, formase inicialmente un peptido feniltiocarbamilado, non rompen as ligazons, e orixinase a feniltiohidantoina do aminoacido NH
2
-terminal + o resto do peptido intacto.
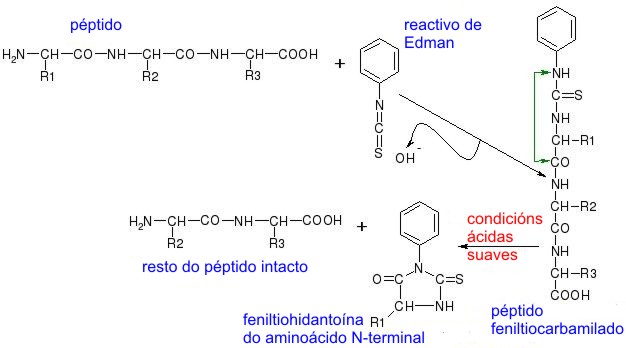
Separanse ambos os compostos e por cromatografia detectase. Co resto do peptido seguese co mesmo procedemento ate ter a secuencia completa.
Este metodo conecese como
Degradacion de Edman
, e e a reaccion que usan os secuenciadores automaticos de proteinas. Pero estes secuenciadores so poden secuenciar os 20-30 primeiros aminoacidos, polo que teremos que hidrolizar e seguir despois. Isto e porque o rendemento non e do 100% e perdemos peptido aos poucos, e ao final non nos queda. So os encimas conseguen un rendemento ao 100%.
Tamen podemos secuenciar empezando polo extremo
carboxilo terminal
, para o que se usan encimas como a
carboxipeptidase
. E unha
protease
que hidroliza as ligazons peptidicas. Esta en concreto e unha exoprotease (ataca a proteina por un extremo) que ataca ao extremo carboxilo terminal.
Empreganse 2 tipos, a
carboxipeptidase A
e
B
. Catalizan a mesma reaccion, pero tenen especificidade distinta. A A so rompe a ligazon peptidica se o aminoacido carboxilo terminal e hidrofobico. A B rompeo se e basico.
Hai que controlar moi ben o tempo de reaccion, xa que cando se libera un carboxilo terminal o seguinte aminoacido convertese no carboxilo terminal.
Respecto das reaccions dos grupos R, existen moitos reactivos que reaccionan de forma especifica con determinados grupos R (OH da
serina
, tiol da
cisteina
...). Isto usase para ver que aminoacido e esencial para o funcionamento da proteina.
Dentro das reaccions de ls grupos R, unha interesante desde o punto de vista de illamento e purificacion de proteinas e a do grupo tiolico (SH) da cisteina, que e fortemente redutor. En presenza de O
2
ten moita tendencia a oxidarse. Se hai duas moleculas de cisteina; en presenza de osixeno, se oxidan para orixinar unha molecula de
cistina
:

Isto ocorre frecuentemente nunha proteina, cando se prega e duas moleculas de cisteina quedan proximas no espazo, xerando unha
ponte disulfuro
. A ponte disulfuro ocorre de forma natural, e debe formarse para estabilizar a estrutura tridimensional da proteina. Con todo, poida que non deba ocorrer de forma natural, por exemplo, se hai cisteinas esenciais expostas (necesarias para a funcionalidade).
Cando illamos unha proteina da sua contorna natural, pomos a proteina en presenza de osixeno, co que eses grupos tiolicos podense oxidar, e a proteina perder a sua funcionalidade.
Para evitar isto, nos medios de illamento e purificacion de proteinas engadimos β-mercapto-etanol, cuxo grupo tiolico e mais redutor que o da propia cisteina; ten mais tendencia a oxidarse.

De modo que ao engadir β-mercapto-etanol, este se oxida e protexe asi os grupos tiolicos da cisteina.
Cando queremos estudar a composicion de aminoacidos dunha proteina temos que hidrolizala completamente, co que temos unha mestura de todo o conxunto de aminoacidos libres que constituen dita proteina.
Para evitar, en toda esta manipulacion, que as Cys que tenamos no medio se oxiden, temos que protexer o seu grupo tiolico engadindo como reactivo
iodoacetato
:

Asi transformamos a cisteina en carboximetilcisteina.
A maioria dos peptidos sintetizanse nos ribosomas ou son resultado da rotura de cadeas polipeptidicas mais grandes (peptidos do leite, peptonas), pero existen tamen peptidos que se orixinan encimaticamente sen intervencion dos ribosomas, que se chaman peptidos non ribosomicos.
Os
peptidos non ribosomicos
son ensamblados por
encimas
que son especificos para cada peptido. O peptido non ribosomico mais comun e o
glutation
, que forma parte dos mecanismos de defensa contra a oxidacion da maioria dos organismos aerobicos.
[
3
]
Outros peptidos non ribosomicos son moito mais frecuentes en
organismos unicelulares
,
plantas
, e
fungos
e son sintetizados por complexos encimaticos modulares chamados
peptido non ribosomico sintetases
, que son independentes dos ribosomas e dos
ARNm
.
[
4
]
Estes complexos poden conter moitos modulos diferentes para poder realizar un conxunto diverso de manipulacions quimicas sobre o produto que estan formando, e cada modulo introduce un aminoacido.
[
5
]
Os peptidos non ribosomicos son con frecuencia ciclicos ou ramificados e poden ter estruturas ciclicas moi complexas, pero son moi comuns tamen os peptidos non ribosomicos lineares. Este sistema ten similitudes coa maquinaria biosintetica para producir
acidos graxos
e
policetidos
, e poden orixinarse moleculas hibridas de peptido-policetido. A presenza dun
oxazol
ou
tiazol
adoita indicar que o composto foi sintetizado desta maneira.
[
6
]