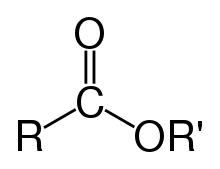
 Загальна будова естер?в
Загальна будова естер?в
Есте?ри
(також
складн?? еф??ри
) ? клас
орган?чних сполук
, пох?дн? кислоти (
орган?чно?
або
неорган?чно?
), в як?й атом водню (H) принаймн? одн??? кислотно?
г?дроксильно?
групи (-OH) ц??? кислоти зам?щений на
орган?льну
групу (-R).
Аналоги, отриман? з кисню, зам?щеного ?ншими
халькогенами
, також належать до категор?? естер?в
[1]
. На думку деяких автор?в, органопох?дн? кислотного водню ?нших кислот також ? естерами (наприклад,
ам?ди
), але не зг?дно з IUPAC
[1]
.
Важливо пам‘ятати, що естери в?др?зняються в?д
простих еф?р?в
(
етер?в
), у яких два
вуглеводнев? радикали
з'?днан? атомом
кисню
(R1-O-R2).
Пох?дн?
карбонових
кислот, в яких атом водню в
карбоксильн?й
(COOH) груп? зам?щено на орган?чний радикал (R').
Назва
естер
походить в?д
н?м.
Es
sig-Ae
ther
? оцтовий еф?р.
За сво?ю будовою естери на перший погляд схож? з
солями
. Насправд? ж схож?сть тут лише формальна. Зв'язок м?ж вуглеводневим радикалом, тобто залишком, який виходить, якщо в?дняти в?д молекули вуглеводню один атом Г?дрогену, ? рештою частини молекули в естер?
ковалентний
, а не
?онний
, як у солях.
Естери, на в?дм?ну в?д б?льшост? солей, нерозчинн? у вод?, але розчиняються в
орган?чних розчинниках
. Розчини ?х не проводять електричного струму.
Реакц?я утворення естеру з? спирту ? кислоти ? оборотною: пряма реакц?я назива?ться
естериф?кац??ю
, а зворотна ?
омиленням
естеру.
Назва склада?ться таким чином: спочатку вказу?ться група
R'
, при?днана до кислоти, пот?м ? назва кислоти ?з суф?ксом
ат
. Наприклад,
етилацетат
(як в назвах неорган?чних солей, наприклад, карбонат натр?ю).
Естери зазвичай розглядають як продукт реакц??
кислоти
з?
спиртом
, наприклад, етилацетат можна сприймати як результат вза?мод??
оцтово? кислоти
?
етанолу
. Досить часто вживають трив?альну назву естер?в. Етилацетат за нею можна назвати етиловим естером оцтово? кислоти. Так само називають естери м?неральних кислот: диметиловий естер
с?рчано? кислоти
?
диметилсульфат
.
Багато естер?в карбонових кислот мають характерн? фруктов? або кв?тков? запахи, через що ?х використовують як штучн?
ароматизатори
. Наприклад:
При зб?льшенн? розм?р?в складових орган?чних груп естер?в, до С
15
?C
30
вони набувають консистенц?? пластичних речовин. Цю групу називають восками, вони, зазвичай, не мають запаху. Бджолиний в?ск м?стить сум?ш р?зних естер?в, один з компонент?в воску, що удалося вид?лити ? визначити його склад, явля? собою
м?рициловий етер
пальм?тиново? кислоти
.
Китайський в?ск
(продукт вид?лення
кошен?л?
? комах Сх?дно? Аз??) м?стить
цериловий етер
церотиново? кислоти
. Кр?м того, воски м?стять в?льн?
карбонов? кислоти
?
спирти
. Воски не змочуються
водою
, розчинн? в
бензин?
,
хлороформ?
,
бензол?
.
Жири
? це естери
гл?церину
. Карбонов? кислоти, що входять до складу жир?в, мають вуглеводневий ланцюг з 9-19 атомами
вуглецю
. Тваринн? жири, в основному, складаються ?з сум?ш?
гл?церид?в
стеариново?
? пальм?тиново? кислоти. Рослинн? ол?? м?стять гл?цериди кислот ?з трохи меншою довжиною вуглецевого ланцюга:
лауриново?
та
м?ристиново?
.
Лляна ол?я
м?стить гл?церид ненасичено?
л?нолево? кислоти
. При нанесенн? тонким шаром на поверхню така ол?я п?д д??ю кисню пов?тря висиха? в ход?
пол?меризац??
по подв?йних зв'язках, при цьому утворю?ться еластична пл?вка, не розчинна у вод? й орган?чних розчинниках. На основ? лляно? ол?? виготовляють натуральну ол?фу.
Естери фосфорно? кислоти
ДНК
,
РНК
та
фосфол?п?ди
в?д?грають важливу роль у житт?д?яльност? живих орган?зм?в.
Основний спос?б синтезу ? вза?мод?я карбоново? кислоти ? спирту, що
катал?зу?ться
кислотою ? супроводжу?ться вид?ленням води. ?сну? велика к?льк?сть р?зновид?в прямо?
естериф?кац??
карбонових кислот, як? в?др?зняються один в?д одного деякими характерними деталями.
Одним ?з старих ? розповсюджених метод?в залиша?ться естериф?кац?я за Ф?шером. Сум?ш карбоново? кислоти ? великого надлишку безводного спирту, що м?стить хлороводень, сульфатну чи p-толуенсульфокислоту, витримують протягом к?лькох годин при 70?80°C. Надлишок спирту зм?щу?
р?вновагу
в сторону утворення складного еф?ру. Метод Ф?шера використовують для одержання складних еф?р?в метилового, етилового й ?нших нижчих спирт?в. В ?нших випадках ефективна модиф?кац?я цього методу, де в якост? розчинника використовують бензен або толуен ?з азеотропною в?дгонкою води в апарат? Д?на-Старка. Катал?затором в цьому випадку ? еф?рат трифтористого бору, p-толуенсульфокислота або р?зн? сильнокисл? кат?ообм?нн? смоли.
Пряма естериф?кац?я карбонових кислот да? найкращ? результати в випадку первинних спирт?в. Складн? еф?ри вторинних спирт?в отримують ?з сильно зниженим виходом, а для синтезу складних еф?р?в третинних спирт?в такий метод не годиться. Складн? еф?ри вторинних ? третинних спирт?в отримують ацилюванням цих спирт?в хлороанг?дридами або
анг?дриди кислот
,
кетенами
.
Нуклеоф?льне S
N
2-зам?щених галогену в первинних ? вторинних алк?лгалоген?ду п?д д??ю карбоксилат-?она в якост? нуклеоф?льного реагенту широко використову?ться зараз для отримання складних еф?р?в. Ран?ше ця звичайна реакц?я б?молекулярного нуклеоф?льного зам?щення мала вкрай обмежену сферу застосування через низький вих?д складних еф?р?в в протонних розчинниках (вода, спирти), де карбоксилат-?он сильно сольватованих за допомогою водневого зв'язку ? тому ма? низьку реакц?йною здатн?стю. Метод м?жфазного катал?зу дозволя? усунути цей недол?к за рахунок розчинност? тетраалк?ламмон?евих солей карбонових кислот в полярних ? малополярних апротонних розчинниках, ? в даний час цей спос?б часто застосову?ться для отримання складних еф?р?в найр?зноман?тн?ших, в тому числ? ? просторово ускладнених кислот, де в?н особливо корисний. В рол? катал?затор?в м?жфазного переносу доц?льно використовувати
18-краун-6
пол?еф?р.
У
реакц?ях нуклеоф?льного зам?щення
нуклеоф?л
зам?щу? OR:
![{\displaystyle {\ce {R-CO-OR + NuH ->[H_2SO_4]R-CO-Nu + ROH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5ca96d64c974835d952325c5d6189c4160cdbdd5)
Найб?льше характерним для естер?в карбонових кислот ?
г?дрол?тичне
(п?д д??ю води) розщеплення етерового зв'язку. Тод? нуклеоф?лом ? OH. У нейтральному середовищ? воно прот?ка? пов?льно ? пом?тно прискорю?ться в присутност? основ або кислот, як? катал?зують цей процес.
Г?дрол?з у присутност? луг?в називають
омиленням
. Процес омилення жир?в проводять у промисловому масштаб?, при цьому одержують
гл?церин
? сол? вищих карбонових кислот, що являють собою
мило
.
Вони також вза?мод?ють з?
спиртами
, утворюючи ?нш? естери, з
ам?аком
та
ам?нами
(первинними та вторинними), утворюючи
ам?ди карбонових кислот
.
Естери можуть
алк?лювати
третинн? ам?ни. При цьому до ам?ну при?дну?ться радикал, ? утворю?ться комплексна с?ль:
![{\displaystyle {\ce {R-CO-OR^1 + NR3 -> R-CO-O- [R^1-NR3]+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3d112a32e34cbf690a0638b8916c131abe224e75)
П?д впливом сильних основ α-карбон може
депротонуватися
:

Утворений
карбоан?он
може реагувати з ?ншою молекулою естеру, утворюючи естер β-оксокислоти. Ця реакц?я ?
конденсац??ю Кляйзена
:


Етилформ?ат
та
етилацетат
використовуються як розчинники
целюлозних
лак?в. Естери на основ? нижчих спирт?в ? кислот використовують у харчов?й промисловост? при створенн? фруктових есенц?й, а на основ? ароматичних спирт?в ? у парфумерн?й промисловост?.
Воски входять до складу косметичних крем?в ? л?карських мазей. Тваринн? жири ? ол?? являють собою сировину для одержання вищих карбонових кислот, мийних засоб?в ? гл?церину.
На основ? рослинних ол?й виготовляють ол?фи, що складають основу ол?йних фарб.
Н?трогл?церин
? в?домий л?карський препарат ? вибухова речовина, основа
динам?ту
.
Складн? еф?ри
сульфатно? кислоти
використовують в
орган?чному синтез?
як алк?лююч? реагенти, а
ортофосфатно?
? як
?нсектициди
.
- ↑
а
б
Chemistry (IUPAC), The International Union of Pure and Applied.
IUPAC - esters (E02219)
.
goldbook.iupac.org
. Процитовано 13 с?чня 2024
.