 Pinnmodell av cystein.
Pinnmodell av cystein.
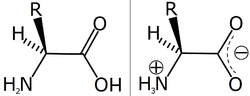 Strukturformel
for en allman alfa-aminosyra i ojoniserad form (vanster) och zwitterjonform (hoger). R betecknar sidokedjan.
Strukturformel
for en allman alfa-aminosyra i ojoniserad form (vanster) och zwitterjonform (hoger). R betecknar sidokedjan.
En
aminosyra
ar en
kemisk forening
som innehaller bade en aminogrupp och en
karboxylgrupp
. Inom
biokemin
syftar ordet oftast pa de 20 aminosyror som
proteiner
bildas av hos daggdjur (det totala antalet kanda naturliga aminosyror overstiger 300).
[
1
]
Proteiner ar
polymerer
av alfa-aminosyror, som halls ihop av
peptidbindningar
mellan kolet i en karboxylgrupp och kvavet i aminogruppen pa nasta aminosyra.
[
1
]
I alfa-aminosyrorna, som aven utanfor proteiner ar de vanligaste aminosyrorna, ar amingruppen bunden till den forsta
kolatomen
, alfa-kolet, efter
karboxylgruppen
. Alfa-kolet ar ocksa bundet till en vateatom och till en sidokedja, som ar speciell for respektive aminosyra. Aminosyrorna som bildar proteiner har
primara amingrupper
med undantag for
prolin
, som har en sekundar amingrupp och ibland raknas som en
iminosyra
.
[
1
]
Aminosyror brukar vanligen delas in i grupper efter sidokedjornas egenskaper:
sura
,
basiska
,
hydrofila
(eller
polara
) och
hydrofoba
(eller
opolara
). Alla aminosyror ar
amfolyter
, da de bade kan ta upp och avge protoner. Karboxylgruppen kan avge en proton till amingruppen, da aminosyran bildar en
amfojon
, aven kallat
zwitterjon
. Zwitterjonen ar amfolyt och dipolar. Vid den
isoelektriska punkten
foreligger alltsa nettoladdning noll.
Essentiella aminosyror
ar aminosyror som kroppen inte kan tillverka genom att bygga om andra aminosyror och som darfor maste tillforas via kosten.
Grenade aminosyror
(BCAA) ar en grupp essentiella aminosyror vars struktur inkluderar en
sidokedja
med en
kolatom
och tre
vateatomer
.
[
2
]
Alla aminosyror kan omvandlas till
karboxylsyror
genom att ta bort dess
aminogrupp
. Detta kan ske genom tva olika metoder,
transaminering
och
deaminering
. Transaminering innebar att aminogruppen fors over fran aminosyran till en karboxylsyra enligt formeln:
- aminosyra
1
+ karboxylsyra
2
 karboxylsyra
1
+ aminosyra
2
karboxylsyra
1
+ aminosyra
2
Vid syntes av de flesta aminosyrorna anvands detta genom transaminering av
glutamat
eller
glutamin
till karboxylsyror som frigjorts i olika mellansteg av
metabolismen
.
Om det istallet finns ett overskott av aminosyror sa kan de
deamineras
, vilket innebar att aminosyran oxideras till en karboxylsyra och ammoniumjoner som ar mycket giftiga och omedelbart gors till
urinamne
.
Karboxylsyrorna som kommer fran de- och transamineringen kan sedan antingen skapas om till aminosyror igen eller brytas ner. Flera kan inga i
citronsyracykeln
medan andra far andra nedbrytningsvagar.
 Strukturformel for prolin. Prolin har en lite annorlunda molekylstruktur an andra aminosyror. Den ar stor, har starka kovalenta bindningar och en fyrkantig struktur som gor den valdigt styv.
Strukturformel for prolin. Prolin har en lite annorlunda molekylstruktur an andra aminosyror. Den ar stor, har starka kovalenta bindningar och en fyrkantig struktur som gor den valdigt styv.
Aminosyror delas in fyra eller fem grupper med avseende pa sina sidokedjor.
De fyra ar:
- Icke-polara sidokedjor (hydrofob)
- Polara sidokedjor (hydrofil)
- Sura sidokedjor
- Basiska sidokedjor
De sura sidokedjorna (karboxyl-syra) ar negativt laddade i neutrala miljoer.
En kemiskt anvandbar aminosyra ar
histidin
som kan fas att byta laddning. Ett exempel pa anvandningsomrade ar histidin-tagg vid
rening av proteiner med hjalp av kolonn
. Da kan man forst halla i sitt blandade startmaterial och fa analyten att fasta till kolonnen (tex. positiv analyt binder till negativt histidin i kolonnen). Sedan byter man laddning pa histidin som da vid skoljning av kolonnen slapper ifran sig den isolerade substansen.
2 aminosyror bildar en dipeptid, 3 aminosyror bildar en tripeptid och sa vidare. Mer an 10 aminosyror bildar en polypeptid, och mer an 50?100 aminosyror bildar ett protein. Aminosyror i en peptid eller ett protein kallas for aminosyrarest.
Den har tabellen visar for varje aminosyra i proteiner:
- Vanligt forekommande en-bokstavs-forkortning
- Vanligt forekommande tre-bokstavs-forkortning
- Sidogruppens kemiska egenskaper
| Forkortn.
|
Fullstandigt namn
|
Typ av sidogrupp
|
Molmassa [g/mol]
|
Ip
|
pK
a1
(α-COOH)
|
pK
a2
(α-
+
NH
3
)
|
pK
aR
(R)
|
Kommentarer
|
| A
|
Ala
|
Alanin
|
hydrofob
|
89,09
|
6,11
|
2,35
|
9,87
|
|
|
| C
|
Cys
|
Cystein
|
hydrofil
|
121,16
|
5,05
|
1,92
|
10,70
|
8,37
|
I oxiderande miljo kan tva cysteiner binda kovalent till varandra,
disulfidbindning
. Denna bindning stabiliserar proteiners tertiarstruktur, till exempel i
insulin
.
|
| D
|
Asp
| Asparaginsyra
|
syra
|
133,10
|
2,85
|
1,99
|
9,90
|
3,90
|
|
| E
|
Glu
| Glutaminsyra
|
syra
|
147,13
|
3,15
|
2,10
|
9,47
|
4,07
|
|
| F
|
Phe
|
Fenylalanin
|
hydrofob
|
165,19
|
5,49
|
2,20
|
9,31
|
|
|
| G
|
Gly
|
Glycin
|
hydrofob
|
75,07
|
6,06
|
2,35
|
9,78
|
|
Eftersom α-kolet binder till tva lika "grupper", vateatomer, ar glycin inte
optiskt aktivt
.
|
| H
|
His
|
Histidin
|
basisk
|
155,16
|
7,60
|
1,80
|
9,33
|
6,04
|
|
| I
|
Ile
|
Isoleucin
|
hydrofob
|
131,17
|
6,05
|
2,32
|
9,76
|
|
|
| K
|
Lys
|
Lysin
|
basisk
|
146,19
|
9,60
|
2,16
|
9,06
|
10,54
|
|
| L
|
Leu
|
Leucin
|
hydrofob
|
131,17
|
6,01
|
2,33
|
9,74
|
|
|
| M
|
Met
|
Metionin
|
hydrofob
|
149,21
|
5,74
|
2,13
|
9,28
|
|
Syntesen (tillverkningen) av nya proteiner i cellerna borjar alltid med en metionin. I manga fall tas denna bort i senare processer.
|
| N
|
Asn
|
Asparagin
|
hydrofil
|
132,12
|
5,41
|
2,14
|
8,72
|
|
|
| P
|
Pro
|
Prolin
|
hydrofob
|
115,13
|
6,30
|
1,95
|
10,64
|
|
Den enda aminosyran dar N-terminalen innehaller ett vate istallet for tva.
|
| Q
|
Gln
|
Glutamin
|
hydrofil
|
146,15
|
5,65
|
2,17
|
9,13
|
|
|
| R
|
Arg
|
Arginin
|
basisk
|
174,20
|
10,76
|
1,82
|
8,99
|
12,48
|
|
| S
|
Ser
|
Serin
|
hydrofil
|
105,09
|
5,68
|
2,19
|
9,21
|
|
|
| T
|
Thr
|
Treonin
|
hydrofil
|
119,12
|
5,60
|
2,09
|
9,10
|
|
|
| V
|
Val
|
Valin
|
hydrofob
|
117,15
|
6,00
|
2,39
|
9,74
|
|
|
| W
|
Trp
|
Tryptofan
|
hydrofob
|
204,23
|
5,89
|
2,46
|
9,41
|
|
|
| Y
|
Tyr
|
Tyrosin
|
hydrofil och hydrofob
[
kalla behovs
]
|
181,19
|
5,64
|
2,20
|
9,21
|
10,46
|
|
-
Nationalencyklopedin 1
. Bra Bocker. 1989. sid. 295.
ISBN 91-7024-621-1
- Sherwood, Martin (1990).
Kemin, Grundamnen & foreningar
. Bonniers. sid. 110.
ISBN 91-34-50893-7
- Champe, Pamela C.; Harvey Richard A., Ferrier Denise R. (2008) (pa engelska).
Biochemistry
. Lippincott's illustrated reviews (4. ed.). Baltimore, MD: Lippincott Williams & Wilkins.
Libris
10531981
.
ISBN 9780781769600