Adelgaser
ar
grundamnena
i
grupp 18
i det
periodiska systemet
. Dessa grundamnen kannetecknas dels av att de ar
icke-metaller
som ogarna reagerar i
kemiska reaktioner
, men aven for att de alla ar i
gasform
vid
standardtryck och -temperatur
. De fem adelgaser som har stabila
isotoper
ar
helium (He)
,
neon (Ne)
,
argon (Ar)
,
krypton (Kr)
och
xenon (Xe)
. Adelgasen
radon (Rn)
ar radioaktiv och pa grund av detta har den studerats mindre an de forsta fem medlemmarna i gruppen. En
syntetisk
medlem av gruppen,
oganesson (Og)
, har ocksa upptackts, men mycket lite ar kant om dess egenskaper pa grund av dess korta
halveringstid
.
Kemiskt sett ar adelgaserna stabila, detta pa grund av att de har maximalt antal
valenselektroner
i sitt yttersta
elektronskal
, vilket i sin tur leder till att de extremt sallan reagerar med andra amnen. Under standardtryck och -temperatur ar de luktlosa, farglosa, enatomiska gaser. Adelgasernas smalt- och kokpunkter ligger mycket nara varandra, alla inom ett intervall pa 10 °C dar de ar flytande. Da adelgaserna pavisar extremt lag kemisk reaktivitet, finns darfor endast ett par hundra kanda adelgasforeningar, betydligt farre an for andra grundamnen.
Neon, argon, krypton och xenon utvinns fran luften genom
gaskondensering
och
fraktionerad destillation
. Helium framstalls oftast fran oljekallor, och radon isoleras vanligtvis fran radioaktiv sonderdelning av losta radiumforeningar.
Adelgaser har manga industriellt viktiga funktioner som
belysning
,
svetsning
och
rymdutforskning
. Helium anvands ofta inom dykning, dar det ersatter en del av luftblandningen. Helium har aven fatt ersatta
vatgas
i
luftskepp
och
ballonger
, da det blev uppenbart att vatgas utgor en stor brandrisk.
 Adelgaser under lagt tryck i glasbehallare.
Adelgaser under lagt tryck i glasbehallare.
Ordet "adelgas" kommer fran det tyska substantivet
Edelgas
, som anvandes for forsta gangen 1898 av
Hugo Erdmann
[
1
]
. "Adel" syftar till den extremt laga reaktiviteten hos grundamnena i grupp 18 i det
periodiska systemet
pavisade under
standardtryck och -temperatur
, pa samma vis som
adelmetaller
ocksa reagerar mycket lite med sin omgivning.
Adelgaserna har aven kallats for "
inerta gaser
", men detta ar en felaktig benamning da alla naturliga adelgaser kan delta i kemiska reaktioner under ratt forhallanden.
[
2
]
"Ovanliga gaser" ar en annan term som anvants,
[
3
]
men aven denna ar felaktig da argon utgor en betydande del (0,94% efter volym, 1,3% efter massa) av
jordens atmosfar
[
4
]
 Helium upptacktes ursprungligen i solen tack vare sina karaktaristiska
spektrallinjer
.
Helium upptacktes ursprungligen i solen tack vare sina karaktaristiska
spektrallinjer
.
Pierre Janssen
och
Joseph Norman Lockyer
var
18 augusti
1868
de forsta att upptacka en adelgas da de studerade
solens
kromosfar
. De gav gasen namnet
helium
efter det
grekiska
ordet for solen,
Helios
(
?λιο?
)
[
5
]
Redan 1784 hade emellertid den engelska kemisten och fysikern
Henry Cavendish
upptackt att luft inneholl en liten mangd av ett amne som var mindre reaktivt an
kvave
.
[
6
]
Ett arhundrade senare, 1895, upptackte
Lord Rayleigh
att kvaveprover fran luften hade en annan
densitet
an det kvave som framstallts genom
kemiska reaktioner
. Tillsammans med forskaren
William Ramsay
la Lord Rayleigh fram en teori om att det kvave som togs fram ur luften var blandat med ytterligare en gas, vilket bekraftades med ett experiment i vilket ett nytt grundamne,
argon
, lyckades isoleras. Namnet fick argon fran det grekiska ordet for "inaktiv" (
αργ?(ν)
).
[
6
]
Med denna upptackt insag man att en hel klass med gaser saknades i det periodiska systemet. Under sokandet efter argon hade Ramsay aven lyckats isolera helium for forsta gangen da han hettade upp
mineralen
cleveit
. 1902 inkluderade
Dmitrij Mendelejev
grundamnena helium och argon i grupp 0 i sin schematiska uppdelning av grundamnena, vilket senare blev det periodiska systemet.
[
7
]
Ramsay fortsatte att leta efter dessa gaser med hjalp av
fraktionerad destillation
, for att pa sa vis separera de olika komponenterna i
flytande luft
. 1898 upptackte han grundamnena
krypton
,
neon
och
xenon
, och han namngav dessa efter de grekiska orden
κρυπτ??
(
kryptos
, dold),
ν?ο?
(
neos
, ny) och
ξ?νο?
(
xenos
, framling).
Radon
upptacktes 1898 av
Friedrich Ernst Dorn
[
8
]
och fick namnet "
radium
emanation", men den ansags inte vara en adelgas forran 1904, da man upptackte att grundamnet liknade de andra adelgaserna.
[
9
]
Rayleigh och Ramsay fick 1904
Nobelpriset
i
fysik
respektive i kemi, for sina upptackter av adelgaserna.
[
10
]
[
11
]
J. E. Cederblom, davarande ordforande i
Kungliga Vetenskapsakademien
, gav motiveringen; "upptackten av en helt ny grupp av grundamnen, av vilken ingen medlem tidigare varit kand, ar nagot verkligt unikt i kemins historia och ett framsteg av hog betydelse inom vetenskapen".
[
11
]
Upptackten av adelgaserna hjalpte till att utveckla en grundlaggande forstaelse av
atomstrukturen
. 1895 forsokte den franske kemisten
Henri Moissan
fa till en reaktion mellan
fluor
, det mest
elektronegativa
grundamnet, och argon, en av adelgaserna. Han misslyckades emellertid med detta och inte forran i slutet av 1900-talet lyckades man bilda en kemisk forening innehallande argon, dessa forsok hjalp dock till att utveckla nya teorier for atomstrukturen. Med utgangspunkt i dessa experiment foreslog den danska fysikern
Niels Bohr
1913 att atomernas elektroner var ordnade i
skal
som omgardade
atomkarnan
och att alla adelgaser forutom helium hade ett yttersta skal innehallande atta elektroner.
[
9
]
1916 skapade
Gilbert N. Lewis
den sa kallade
oktettregeln
, som slot sig till att en oktett av elektroner var det mest stabila arrangemanget for en atom; detta gjorde att atomen ogarna reagerade med andra grundamnen da den inte behovde nagra fler elektroner for att fylla sitt yttre skal.
[
12
]
Inte forran 1962 upptackte
Neil Bartlett
den forsta kemiska foreningen med en adelgas,
xenonhexafluorplatinat
.
[
13
]
Foreningar med andra adelgaser upptacktes kort darpa; 1962 for radon,
radonfluorid
,
[
14
]
och 1963 for krypton,
kryptondifluorid
(KrF
2
).
[
15
]
Den forsta stabila foreningen med argon upptacktes inte forran 2000 da
argonfluorhydrid
(HArF) bildades vid temperaturen 40 K (?233 °C).
[
16
]
I december 1998 bombarderade en grupp forskare vid
Joint Institute for Nuclear Research
i
Dubna
,
Ryssland
plutonium (Pu)
med
kalcium (Ca)
for att skapa en atom av grundamne 114,
[
17
]
som senare fick namnet
flerovium (Fl)
.
[
18
]
Tidiga kemiska experiment har pavisat att grundamnet kan vara den forsta
transuranen
att ha egenskaper liknande de hos adelgaserna, detta trots att det tillhor
grupp 14
i det periodiska systemet.
[
19
]
I oktober 2006 lyckades forskare vid Joint Institute for Nuclear Research och
Lawrence Livermore National Laboratory
att framstalla den forsta atomen av
oganesson (Og)
, det sjunde grundamnet i grupp 18,
[
20
]
genom att bombardera
californium (Cf)
med
kalcium (Ca)
.
[
21
]
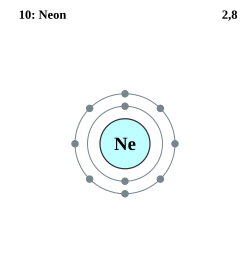 Neon har, likt alla adelgaser, ett fullt
valensskal
. Adelgaser har atta elektroner i det yttersta skalet, forutom helium som endast har tva.
Neon har, likt alla adelgaser, ett fullt
valensskal
. Adelgaser har atta elektroner i det yttersta skalet, forutom helium som endast har tva.
Adelgaser utgor tillsammans grupp 18 i det
periodiska systemet
. De grundamnen som bekraftats hora till den har gruppen ar
helium (He)
,
neon (Ne)
,
argon (Ar)
,
krypton (Kr)
,
xenon (Xe)
och
radon (Rn)
.
[
22
]
Dessa grundamnen ar farg-, lukt- och smaklosa, och svarantandliga under normala forhallanden. Gruppen kallades tidigare for
grupp 0
da man trodde att dessa amnen saknade valenselektroner, vilket skulle innebara att
atomerna
inte kunde bilda
kemiska foreningar
. Senare upptackte man emellertid att aven adelgaserna kunde bilda foreningar och benamningen slutade anvandas.
[
9
]
Valdigt lite ar idag kant om adelgasernas senaste medlem,
oganesson (Og)
.
[
23
]
Adelgaserna har fulla yttre
elektronskal
(valensskal).
Valenselektroner
ar de yttersta
elektronerna
i en atom och ar normalt sett de enda som ar delaktiga i
kemiska bindningar
. Atomer med fulla valensskal ar extremt stabila och bildar darfor valdigt sallan kemiska foreningar och de har aven valdigt svart att ta till sig eller forlora elektroner.
[
24
]
Pa grund av den svagare
elektromagnetiska kraften
hos tyngre adelgaser kan elektroner avlagsnas lattare fran t.ex. en radon-atom an fran en lattare helium-atom.
Tack vare att adelgaserna har ett fullt yttre skal kan de anvandas tillsammans med teckensystemet for
elektronkonfiguration
for att bilda ett "adelgassystem". For att gora detta skrivs den narmsta adelgasen som kommer fore grundamnet i fraga forst och sedan elektronkonfigurationen darifran. Exempelvis ar det klassiska elektronkonfigurationssystemet for
kol
1s²2s²2p² och adelgassystemet [He]2s²2p². Detta teckensystem gor det enklare att identifiera grundamnen samtidigt som det ar kortare att skriva an det fullstandiga atomorbitalerna.
[
25
]
Pa grund av det fulla valensskalet i
argon
anvands gasen i glodlampor for att forhindra syretillforsel och for att strommen i lampan inte ska bilda gnistor.
- Den har artikeln ar helt eller delvis baserad pa material fran
engelsksprakiga Wikipedia
.
- ^
Edward Renouf (15 februari 1901). ”Noble gases”.
Science
13: sid. 268?270.
- ^
Ozima 2002
, s. 30.
- ^
Ozima 2002
, s. 4.
- ^
"
Argon
".
Encyclopædia Britannica
. (2008).
- ^
Oxford English Dictionary
(1989), s.v. "helium". Hamtdatum
16 december
2006
, fran Oxford English Dictionary Online. Se aven citat: Thomson, W. (1872).
Rep. Brit. Assoc.
xcix: "Frankland and Lockyer find the yellow prominences to give a very decided bright line not far from D, but hitherto not identified with any terrestrial flame. It seems to indicate a new substance, which they propose to call Helium."
- ^ [
a
b
]
Ozima 2002
, s. 1.
- ^
Mendeleev 1903
, s. 497.
- ^
J. R. Partington (May 1957). ”Discovery of Radon”.
Nature
179 (4566): sid. 912.
doi
:
10.1038/179912a0
.
- ^ [
a
b
c
]
"
Noble Gas
".
Encyclopædia Britannica
. (2008).
- ^
J.E. Cederblom (1904).
”The Nobel Prize in Physics 1904 Presentation Speech”
.
https://www.nobelprize.org/prizes/physics/1904/ceremony-speech/
.
- ^ [
a
b
]
Fri oversattning fran
J.E. Cederblom (1904).
”The Nobel Prize in Chemistry 1904 Presentation Speech”
.
https://www.nobelprize.org/prizes/chemistry/1904/ceremony-speech/
.
- ^
Gillespie RJ, Robinson EA (2007). ”Gilbert N. Lewis and the chemical bond: the electron pair and the octet rule from 1916 to the present day”.
J Comput Chem
28 (1): sid. 87?97.
doi
:
10.1002/jcc.20545
.
PMID 17109437
.
- ^
N. Bartlett (1962). ”Xenon hexafluoroplatinate Xe
+
[PtF|6|]
?
”.
Proceedings of the Chemical Society
(6): sid. 218.
doi
:
10.1039/PS9620000197
.
- ^
”Radon Fluoride”.
Journal of the American Chemical Society
84 (21): sid. 4164?4165. 1962.
doi
:
10.1021/ja00880a048
.
- ^
Grosse, A. V.; Kirschenbaum, A. D.; Streng, A. G.; Streng, L. V. (1963). ”Krypton Tetrafluoride: Preparation and Some Properties”.
Science
139: sid. 1047?1048.
doi
:
10.1126/science.139.3559.1047
.
PMID 17812982
.
- ^
- ^
Oganessian, Yu. Ts. (1999). ”Synthesis of Superheavy Nuclei in the
48
Ca +
244
Pu Reaction”.
Physical Review Letters
(
American Physical Society
) 83: sid. 3154.
doi
:
10.1103/PhysRevLett.83.3154
.
- ^
Woods, Michael (6 maj 2003).
”Chemical element No. 110 finally gets a name?darmstadtium”
.
Pittsburgh Post-Gazette
.
http://www.post-gazette.com/healthscience/20030506element0506p4.asp
. Last 26 juni 2008
.
- ^
”Gas Phase Chemistry of Superheavy Elements”
.
Texas A&M University
. Arkiverad fran
originalet
den 28 maj 2008
.
https://web.archive.org/web/20080528125641/http://lch.web.psi.ch/pdf/TexasA%26M/TexasA%26M.pdf
. Last 31 maj 2008
.
- ^
Wilson, Elaine (2005). ”Making Meaning in Chemistry Lessons”.
Electronic Journal of Literacy through Science
4 (2).
- ^
Oganessian, Yu. Ts. (9 oktober 2006). ”Synthesis of the isotopes of elements 118 and 116 in the
249
Cf and
245
Cm +
48
Ca fusion reactions”.
Physical Review
C
74 (4): sid. 44602.
doi
:
10.1103/PhysRevC.74.044602
.
- ^
Ozima 2002
, s. 2.
- ^
”Oganesson”
. WebElements Periodic Table
.
https://www.webelements.com/oganesson/
. Last 19 december 2018
.
- ^
Ozima 2002
, s. 35.
- ^
CliffsNotes 2007
, s. 15.