 (AA) батери?е
(AA) батери?е
У науци и технологи?и,
батери?а
?е електрохеми?ски уре?а? у коме ?е ускладиштена
хеми?ска енерги?а
(у виду
потенци?алне енерги?е
), ко?а се може претворити у
електричну енерги?у
када се кра?еви батери?е, електроде, спо?е проводником. Батери?а ?е уре?а? ко?и се састо?и од ?едне или више
електрохеми?ских ?ели?а
са спо?ним прик?учцима за напа?а?е електричних уре?а?а као што су
батери?ске лампе
,
паметни телефони
, и
електрична кола
.
[1]
Кад батери?а пружа
електричну снагу
, ?ен позитивни прик?учак ?е
катода
, а ?ен негативни прик?учак ?е
анода
.
[2]
Терминал означен као негативан ?е извор електрона ко?и ?е те?и кроз спо?аш?е електрично коло до позитивног терминала. Катода и анода дакле, ме?усобно повезани преко спо?ног кола, представ?а?у меди?ум за пренос наелектриса?а и при томе учеству?у у редокс реакци?ама као активне масе. Pедокс процеси - процеси ко?и да?у енерги?у, одви?а?у се на граници фазе електрода/електролит, док се електрони (ослобо?ени из аноде током реакци?а оксидаци?е) транспорту?у кроз спо?ни електрични круг (до катоде) ствара?у?и да?е електричну енерги?е ко?а се може користити за напа?а?е потрошача. Другим речима, када се батери?а повеже на спо?аш?е електрично оптере?е?е,
редокс
реакци?а конверту?е високо-енергетске реактанте у производе ниске енерги?е, и разлика
слободне енерги?е
се испоручу?е спо?аш?ем колу као електрична енерги?а. Електролит ?е хеми?скa врста ко?a ?е истовремено и електронски изолатор - физички раздва?а аноду и катоду и ?онски проводник - има улогу да осигура транспорт ?онских врста изме?у електрода.
[3]
Истори?ски термин ?батери?а” се специфично односио на уре?а? ко?и се састо?ао од вишеструких ?ели?а, ме?утим ?егова употреба ?е еволуирала тако да сада обухвата уре?а?е ко?и се састо?е од ?едне ?ели?е.
[4]
Прва позната батери?а ?е
Багдадска батери?а
из периода 250. п. н. е. и 640. п. н. е. Модерне батери?е раде на принципу ко?и ?е изумео
итали?ански
физичар
Алесандро Волта
1800
. године.
Батери?е спада?у у такозване примарне изворе електричне енерги?е, ?ер претвара?у хеми?ску енерги?у у електричну и не могу се пунити (процес ни?е реверзибилан). За разлику од батери?а,
акумулатор
спада у секундарне електрохеми?ске изворе (реверзибилне) електричне енерги?е и може више пута претварати хеми?ску у електричну енерги?у и обрнуто (може се пунити и празнити). Други назив за батери?у ?е примарни
галвански елемент
. Галвански елементи су примарни хеми?ски извори стру?е. Посто?и више врста галванских елемената: Волтин, Дани?елов, Лекланшов итд. Дани?еловим елементом може се на ?едноставан начин об?аснити принцип батери?е. Дани?елов елемент се састо?и од цинкане електроде потоп?ене у раствор
цинк-сулфата
(ZnSO
4
) и бакарне електроде ко?а се налази у раствору
бакар-сулфата
(CuSO
4
), ?едни од другог одво?ени су посудом од порозног матери?ала кроз чи?е зидове могу да пролазе само ?они SO
4
. Када се цинкана електрода стави у разблажени водени раствор цинк-сулфата атоми
цинка
спонтано прелазе у раствор као позитивни ?они Zn
2+
остав?а?у?и сво?а два електрона на електроди. Прелаже?ем ?она цинка у раствор, електрода поста?е негативно наелектрисана, а раствор позитивно. У врло танком пограничном сло?у изме?у цинкане електроде и раствора наста?е електрично по?е усмерено тако да се супротстав?а прелаже?у ?она Zn
2+
у раствор. Што више ?она пре?е у раствор, ово по?е ?е све ?аче. Убрзо то електрично по?е достиже ону вредност при ко?о? се електрична сила из?едначава са хеми?ском, те се да?е прелаже?е ?она Zn
2+
у раствор заустав?а и наелектриса?е електроде и раствора се више не пове?ава?у.
Батери?е су доступне у мноштву облика и величина, од мини?атурних ?ели?а ко?е се користе за напа?а?е
слушних апарата
и ручних сатова до малих, танких ?ели?а ко?е се користе у
паметним телефонима
, до великих
оловно киселинских батери?а
или лити?ум-?онских батери?а у возилима, и у кра??ем екстрему, огромне батери?ске банке величине собе ко?а пружа резервну или хитну снагу за
телефонске централе
и рачунарске
дата центре
. Према процени из 2005. године, индустри?а батери?а ?е широм света генерисала 48 америчких долара
мили?арди
у прода?и сваке године,
[5]
са годиш?им растом од 6%.
Употреба ?батери?е” за описива?е групе електричних уре?а?а датира из времена
Бен?амина Френклина
, ко?и ?е 1748. године описао вишеструке
Ле?денске
посуде по аналоги?и са
батери?ом топова
[6]
(Бен?амин Френклин ?е поза?мио термин ?батери?а” из во?ске, где се односи на оруж?е ко?е за?еднички де?ству?е
[7]
).
Итали?ански физичар
Алесандро Волта
израдио ?е и описао прву електрохеми?ску батери?у,
волтни елемент
, 1800. године.
[8]
Она се састо?ала од бакарне шичке и цинкане плоче, раздво?ених
расолом
натоп?еним папирним дисковима. Она ?е могла да производи посто?ану стру?у током знатног временског периода. Волта ни?е разумео да ?е напон последица хеми?ских реакци?а. Он ?е сматрао да су ?егове ?ели?е неисцрпан извор енерги?е,
[9]
и да су повезани корозиони ефекти на електродама пука непри?атност, а не неизбежна последица ?иховог рада, као што ?е то показао
Ма?кл Фараде?
1834. године.
[10]
Ране батери?е су биле од велике важности у експериментално? примени, ме?утим у пракси су ?ихови напони флуктуирали и оне нису могле да обезбеде велику стру?у током дужих периода.
Дани?елову ?ели?у
?е измео 1836. године британски хемичар
?он Фредерик Дани?ел
. Она ?е била први практични извор електирцитета, тако да ?е постала индустри?ски стандард и доживела широку адаптаци?у као извор напа?а?а за мреже
електричних телеграфа
.
[11]
Она се састо?ала од бакарне посуде напу?ене
бакар сулфатним
раствором, у ко?и ?е био уро?ен неглазирани
глинени
суд напу?ен
сумпорном киселином
са цинканом електродом.
[12]
Ове влажне ?ели?е су користиле течне електролите, те су биле склоне цуре?у и просипа?у, ако се ?има ни?е правилно руковало. Многе су користиле стаклене посуде за држа?е ?ихових компоненти, што их ?е чинило крхким и потенци?ално опасним. Ове карактеристике су учиниле влажне чели?е неподобним за портабилне видове примене. При кра?у деветнаестог века, изум батери?а са
сувим ?ели?ама
, у ко?има су течни електролити заме?ени пастом, учинио ?е практичним портабилне електричне уре?а?е.
[13]
Посто?е разни уре?а?и ко?и има?у способност да на ?едном (негативном) прик?учку нагомила?у слободне
електроне
, ко?и зато недоста?у на другом кра?у уре?а?а или позитивном прик?учку. Такав учинак може се пости?и на пример физичко-хеми?ским реакци?ама у тзв.
Лекланшовом чланку
, ко?и ?е бо?е познат под изразом батери?ски чланак или батери?а.
[14]
[15]
[16]
Лекланшов чланак ?е врста галванског чланка ко?и ?е добио име по француском електричару
Жоржу Лекланшу
. Она се састо?и од суда од цинка у ко?и се см?ешта хеми?ски активна матери?а - тзв. електролит и у ?ему уро?ен уг?ена шипка. Такав чланак захва?у?у?и физичко-хеми?ским процесима у електролиту ствара разлику потенци?ала од 1,5 V на сво?им изводима. При томе ?е се електрони гомилати на цинканом суду, т?. цинкани плашт прикуп?а негативни извод, а уг?ена шипка позитивни извод или пол батери?е.
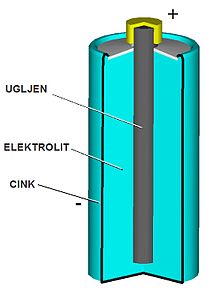 Лекланшов чланак
Лекланшов чланак
Негативни пол (
анода
) ?е
цинкана
чашица. Позитивни пол (
катода
) ?е
уг?ени
штапи? у смеси
манган-диоксида
(MnO
2
) и уг?ене прашине (
ча?и
). Електролит ?е водени раствор
амони?ум хлорида
(NH
4
Cl
(aq)
) и
цинк хлорида
(ZnCl
2
) ко?и ?е додава?ем
скроба
претворен у пасту.
Затвара?ем
стру?ног кола
изме?у негативног и позитивног пола (искориштава?а ?батери?е”), почи?у реакци?е:
- анодна реакци?а на негативном полу (чашици):
- Zn → Zn
2+
+ 2e
-
- катодна реакци?а на позитивном полу (штапи?у):
- 2MnO
2
+ 2e
-
+ 2NH
4
+
→ Mn
2
O
3
+ 2NH
3
+ H
2
O
Збра?а?ем те две реакци?е се доби?а:
- Zn + 2MnO
2
+ 2NH
4
+
→ Zn
2+
+ Mn
2
O
3
+ 2NH
3
+ H
2
O
Дакле, на негативном се полу ослоба?а?у два
електрона
ко?а путу?у кроз потрошач (где обав?а?у одре?ени рад) те долазе до позитивног пола, где учеству?у у хеми?ско? реакци?и. Кад се сав цинк на чашици ?потроши” (односно кад ве?ина цинка отпусти по два електрона), хеми?ска реакци?а више ни?е могу?а па се каже да ?е ?батери?а празна”. Лекланшов чланак ни?е поново пу?ив, односно након ?потрош?е” цинка поста?е неупотреб?ив. Покуша? пу?е?а батери?а ко?е нису за то предви?ене, редовно резултира експлодира?ем, или у на?ма?у руку ?надувава?ем” батери?е с цуре?ем агресивог електролита ко?и нагриза уре?а?е у ко?е ?е батери?а уложена.
 Неколико врста батери?а. Лево горе: акубатери?а за
фотоапарат
Неколико врста батери?а. Лево горе: акубатери?а за
фотоапарат
Нови Лекланшов чланак (цинк-уга?) да?е напон од 1,5 V. Неке врсте батери?а (лити?умске, никал-кадми?умске и др.) могу ме?утим имати и ма?и радни напон, т?. 1,2 V по чланку. За ве?е напоне, комбину?е се (повезу?е се у сери?у) више чланака. Батери?е има?у мали капацитет, па се користе за уре?а?е с малом потрош?ом стру?е. За ве?у потрош?у користе се акумулатори или исправ?ачи, ко?и прик?учени на градску електричну мрежу, поста?у ?едносмерни извор. Исправ?ачи се често угра?у?у у уре?а? ко?и напа?а?у.
 ?едноставан електрични модел батери?е.
?едноставан електрични модел батери?е.
?ели?е у батери?и могу бити повезане паралелно, сери?ски или комбиновано. Паралелна веза представ?а везу истоимених електрода и да?е исти напон као ?една ?ели?а, али ?ачу стру?у због сма?ене унутраш?е отпорности извора. Сери?ска веза представ?а везу где се катода ?едне везу?е на аноду друге ?ели?е што на кра?у да?е исту стру?у као ?една ?ели?а али ве?и напон. На?ве?и бро? батери?а ко?е се користе у пракси има сери?ску везу.
Посто?и више врста батери?а:
- Ni-Cd (никал-кадми?ум) батери?а. Она представ?а прву широко прихва?ену пу?иву батери?у опште намене. Иако ?о? ?е хеми?ски састав еколошки неприхва?ен, велики животни век чини ?е и данас врло погодном за одре?ене примене.
- Ni-MH (никал метални хидрид) батери?е су врло раширен тип батери?а за мобилне телефоне. Одлику?е их 30% ве?и капацитет од NiCd батери?а.
- Li-?он (лити?умски ?он) батери?е су савремени тип батери?е ко?е данас преовладава?у као извор напа?а?а мобилних телефона. Одлику?е их мала маса, знатно ве?и капацитет од NiMH батери?а и ве?и напон, али су саме по себи врло осет?иве.
- Лити?ум-полимер ?е нова генераци?а батери?а са сво?ствома врло сличним Li-?онским батри?ама.
- Цинк-ваздух су батери?е нове технологи?е.
На комерци?алним батери?ама на?чеш?е пише да се не могу (не сме?у) пунити, ?ер може до?и до ?иховог претераног загрева?а, па чак и експлози?е. Пошто се у батери?ама налазе хеми?ска ?еди?е?а опасна по ?удски организам и животну средину потребно ?е обратити паж?у при рукова?у са ?има.
- Треба водити рачуна да нарочито мала деца не до?у у контакт са батери?ама, ?ер ?е опасно да их прогута?у (може до?и до трова?а).
- После употребе (празне) батери?е не треба бацати на сметлиште или у природу ве? их треба прикуп?ати и рециклирати, како се не би зага?ивала вода и зем?иште (
животна средина
).
- ^
Crompton, T.R. (2000).
Battery Reference Book
(third изд.). Newnes. стр. Glossary 3.
ISBN
978-0-08-049995-6
. Приступ?ено
18. 3. 2016
.
- ^
Pauling, Linus (1988). ?15: Oxidation-Reduction Reactions; Electrolysis.”.
General Chemistry
. New York: Dover Publications, Inc. стр.
539
.
ISBN
978-0-486-65622-9
.
- ^
Dell, Ronald M.; Rand, David A. J. (ур.),
Energy storage in batteries
, Royal Society of Chemistry, стр. 1?8,
ISBN
978-0-85404-605-8
, Приступ?ено
2020-10-19
- ^
Pistoia, Gianfranco (2005).
Batteries for Portable Devices
. Elsevier. стр. 1.
ISBN
978-0-08-045556-3
. Приступ?ено
18. 3. 2016
.
- ^
Power Shift: DFJ on the lookout for more power source investments
Архивирано
2005-12-01 на са?ту
Wayback Machine
.
Draper Fisher Jurvetson
. Приступ?ено 20 November 2005.
- ^
Bellis, Mary.
History of the Electric Battery
Архивирано
на са?ту
Wayback Machine
(7. март 2023).
About.com
. Приступ?ено 11 August 2008.
- ^
Society, National Geographic.
?Quiz: What You Don't Know About Batteries”
.
National Geographic
.
- ^
Bellis, Mary.
Biography of Alessandro Volta ? Stored Electricity and the First Battery
Архивирано
на са?ту
Wayback Machine
(18. фебруар 2020).
About.com
. Приступ?ено 7 August 2008.
- ^
Stinner, Arthur.
Alessandro Volta and Luigi Galvani
Архивирано
2008-09-10 на са?ту
Wayback Machine
(PDF). Приступ?ено 11 August 2008.
- ^
Electric Battery History ? Invention of the Electric Battery
Архивирано
на са?ту
Wayback Machine
(22. фебруар 2019).
The Great Idea Finder
. Приступ?ено 11 August 2008.
- ^
Battery History, Technology, Applications and Development
.
MPower Solutions Ltd
. Приступ?ено 19 March 2007.
- ^
Borvon, Gerard (10. 9. 2012).
?History of the electrical units”
. Association S-EAU-S.
- ^
?Columbia Dry Cell Battery”
.
National Historic Chemical Landmarks
. American Chemical Society. Архивирано из
оригинала
23. 2. 2013. г
. Приступ?ено
25. 3. 2013
.
- ^
Leclanche, "
une pile a oxyde insoluble
" [an insoluble oxide battery], French patent no. 71,865 (issued: 8 June 1866) in:
French Ministry of Agriculture and Commerce (1881).
Description des machines et procedes pour lesquels des brevets d'invention ont ete pris …
[
Descriptions of machines and procedures for which patents have been taken …
] (на ?езику: French). vol. 98. Paris, France: Imprimerie Nationale. стр. 33?34.
- ^
Leclanche, Georges (1868).
?Quelques observations sur l’emploi des piles electriques. Pile constante au peroxyde de manganese a un seul liquide.”
.
Les mondes
.
16
: 532.
- ^
Jensen, William B. (?ануар 2014).
?The Leclanche Cell. Museum Notes, Oesper Collections.”
. Приступ?ено
26. 12. 2017
.
- Pistoia, Gianfranco (2005).
Batteries for Portable Devices
. Elsevier. стр. 1.
ISBN
978-0-08-045556-3
. Приступ?ено
18. 3. 2016
.
- Pauling, Linus (1988). ?15: Oxidation-Reduction Reactions; Electrolysis.”.
General Chemistry
. New York: Dover Publications, Inc. стр.
539
.
ISBN
978-0-486-65622-9
.
- Crompton, T.R. (2000).
Battery Reference Book
(third изд.). Newnes. стр. Glossary 3.
ISBN
978-0-08-049995-6
. Приступ?ено
18. 3. 2016
.
- Dingrando, Laurel; et al. (2007).
Chemistry: Matter and Change
. New York: Glencoe/McGraw-Hill.
ISBN
978-0-07-877237-5
.
Ch. 21 (pp. 662?695) is on electrochemistry.
- Fink, Donald G.
; Beaty, H. Wayne (1978).
Standard Handbook for Electrical Engineers, Eleventh Edition
. New York: McGraw-Hill.
ISBN
978-0-07-020974-9
.
- Knight, Randall D. (2004).
Physics for Scientists and Engineers: A Strategic Approach
. San Francisco: Pearson Education.
ISBN
978-0-8053-8960-9
.
Chs. 28?31 (pp. 879?995) contain information on electric potential.
- Linden, David; Reddy, Thomas B. (2001).
Handbook of Batteries
. New York: McGraw-Hill.
ISBN
978-0-07-135978-8
.
- Saslow, Wayne M. (2002).
Electricity, Magnetism, and Light
. Toronto: Thomson Learning.
ISBN
978-0-12-619455-5
.
Chs. 8?9 (pp. 336?418) have more information on batteries.
|
|---|
| Ме?ународне
| |
|---|
| Државне
| |
|---|
| Остале
| |
|---|