| Vodik
|
|
|
| Osnovna svojstva
|
| Kemijski element
,
Simbol
,
Atomski broj
|
Vodik, H, 1
|
| Kemijska skupina
|
nemetali
|
| Grupa, perioda,
Blok
|
1
,
1
,
s
|
| Izgled
|
bezbojni
plin
|
| Gusto?a
1
|
0,08988 kg/m
3
|
| Tvrdo?a
|
-
|
| Specifi?ni toplinski kapacitet
(c
p
ili c
V
)
2
|
(25 °C) (H
2
) 28.836 J mol
?1
K
?1
|
| Tali?te
|
?259,14 °C
|
| Vreli?te
3
|
?252,87 °C
|
| Toplina taljenja
|
(H
2
) 0,117 kJ mol
-1
|
| Toplina isparivanja
|
(H
2
) 0,904 kJ mol
-1
|
|
1
pri
standardnom tlaku i temperaturi
2
pri konstantnom tlaku ili volumenu
3
pri standardnom tlaku
|
| Atomska svojstva
|
| Atomska masa
|
1,00794(7)
|
| Elektronska konfiguracija
|
[
1
] 1s
1
|
Vodik
je
kemijski element
koji u
periodnom sustavu elemenata
nosi simbol
H
,
atomski
(redni) broj mu je 1, a
atomska masa
mu iznosi 1,00794(7).
Vodik
nema određen polo?aj u periodnom sustavu. Ima jedan valentni
elektron
kao
alkalijski metali
, a od njih se razlikuje mnogo ve?om energijom
ionizacije
. Za stabilnu elektronsku konfiguraciju nedostaje mu jedan
elektron
. Vodik bi se mogao smatrati
halogenim elementom
, ali od njih ima manju
elektronegativnost
i afinitet prema elektronu, pa se zbog toga prou?ava zasebno. ?ini 75% mase
svemira
, te je ishodi?na tvar iz koje su
nuklearnom fuzijom
nastali ostali elementi.
Zvijezde
u
glavnom nizu
se uglavnom sastoje od vodika, u obliku
plazme
. Elementarni vodik na
Zemlji
je u vrlo malim koli?inama.
[1]
Elementarni vodik sastoji se od
obi?nog vodika (procija)
(>99,98%), dok ostatak (gotovo 0,02%) ?ini te?ki vodik (
deuterij
) s tragovima superte?kog vodika (
tricija
). Vodik stvara kemijske veze sa najvi?e elemenata, posebno u
organskim tvarima
.
Pri standardnom tlaku i temperaturi
, vodik je plin bez boje, mirisa i okusa, 14,4 puta lak?i od
zraka
. Neotrovan je.
Slabo je
topljiv
u polarnim, a bolje u nepolarnim otapalima.
Hydrogen spectrum test
Industrijski se najvi?e dobija iz
zemnog plina
, a rjeđe
elektrolizom
vode
. Najvi?e se koristi u proizvodnji
fosilnih goriva
(hidrokrakiranje ? pove?anje kvalitete goriva) i za dobivanje
amonijaka
, u proizvodnji umjetnih goriva. U
metalurgiji
nije ba? po?eljan, jer mnoge
metale
?ini lomljivim i krtim, pa stvara pote?ko?e u izgradnji cjevovoda i metalnih spremnika.
[2]
[3]
Iako ga nije prvi proizveo (prvi ga je proizveo
Paracelsus
u 16. st. reakcijom metala i jake kisline), vodik (
lat.
Hydrogenium
) je definirao
Britanac
Henry Cavendish
1766
.
[4]
i nazvao ga "zapaljivim zrakom". Cavendish ga je dobio reakcijom
cinka
i
klorovodi?ne kiseline
. Definirao je o kojem se plinu radi i dokazao da reakcijom vodika i kisika nastaje
voda
. Zbog toga svojstva
Antoine Lavoisier
ga
1783.
naziva
hydrogene
, od
gr?kog
"onaj koji stvara vodu" (gr?. ?δωρ = voda, γεν?? = stvaratelj). Hrvatski naziv uveo je
Bogoslav ?ulek
.
Teku?i vodik je dobio prvi put 1898. James Dewar, a godinu kasnije je stvorio i kruti vodik.
Deuterij
je dobio 1931.
Harold Urey
, a godinu kasnije je stvorili i
te?ku vodu
. 1934.
Ernest Rutherford
i njegov tim su proizveli
tricij
.
[5]
 Vodikove emisione linije u vidljivom dijelu spektra. Postoje 4 vidljive linije
Balmerove serije
Vodikove emisione linije u vidljivom dijelu spektra. Postoje 4 vidljive linije
Balmerove serije
Prvi
balon na vru?i zrak
je otkrio 1783. Jacques Charles.
Ferdinand von Zeppelin
je napravio letjelicu na vodik, koja je imala prvi let 1900., a kasnije je nazvana
cepelin
.
Nikal
? vodikove
baterije
su se prvi puta koristile 1977, a kasnije ih je koristila
Međunarodna svemirska postaja
,
svemirske letjelice
2001 Mars Odyssey
i
Mars Global Surveyor
, te
svemirski teleskop Hubble
, kome je prvo pakovanje baterija trajalo 19 godina.
[6]
 NGC 604 galaksija, ogromno podru?je ioniziranog vodika u
zvije?đu Trokut
NGC 604 galaksija, ogromno podru?je ioniziranog vodika u
zvije?đu Trokut
Zbog svoje jednostavne
atomske
strukture, koja se sastoji od jednog
protona
i
elektrona
, atom vodika sa svojim
vodikovim spektralnim linijama
svjetlosti (emisija i apsorpcija ?
Balmerova serija
,
Lymanova serija
itd.), je imao sredi?nju ulogu u razvoju
teorije atomske strukture
. Osim toga, atom vodika i odgovaraju?i kationi H
2
+
su imali va?nu ulogu u razumijevanju prirode
kemijskih veza
, ?ija se teorija razvila 1920-tih.
[7]
Prije razvoja
kvantne mehanike
,
Maxwell
je uo?io da
specifi?ni toplinski kapacitet
molekule H
2
ima neobja?njivo odstupanje na niskim temperaturama, gdje se H
2
po?inje vi?e pona?ati kao jednoatomni plin. Prema kvantnoj teoriji, ta pojava se de?ava zbog prostora energetskih nivoa, koji su na?iroko raspoređeni kod H
2
zbog male mase. Taj veliki prostor energetskih nivoa onemogu?uje ravnomjernu raspodjelu toplinske energije kod vodika na niskim temperaturama.
[8]
Pri
standardnom tlaku i temperaturi
, vodik je
plin
bez boje, mirisa i okusa, 14.4 puta lak?i od zraka. Neotrovan je. Slabo je topljiv u polarnim, a bolje u nepolarnim otapalima.
Ohlađen na temperaturu vreli?ta, kondenzira se u bezbojnu
teku?inu
koja je najlak?a od svih teku?ina. Daljnjim odvođenjem topline skru?uje se u prozirnu
krutinu
heksagonske kristalne strukture.
Zapaljen na zraku pri 560 °C, izgara gotovo nevidljivim plamenom u vodu:
2 H
2(g)
+ O
2(g)
→ 2 H
2
O
(l)
 = 286 kJ mol
-1
= 286 kJ mol
-1
Na sobnoj temperaturi nije previ?e reaktivan, no pri vi?im temperaturama ulazi u niz reakcija. Otapa se u mnogim metalima, kao ?to je
platina
.
Pri sobnoj temperaturi bez
katalizatora
, reagira samo s
fluorom
i
vanadijem
u prahu. Razlog slaboj reaktivnosti molekularnog vodika pri sobnoj temperaturi jaka je jednostruka
kovalentna veza
u molekuli. Ta veza je najja?a od svih jednostrukih kovalentnih veza između dvaju istovrsnih atoma. Pri povi?enoj temperaturi spaja se i s kisikom iz mnogih
oksida
, te tako djeluje kao redukcijsko sredstvo.
 Niz proton-proton
prevladava kod zvijezdi veli?ine na?eg Sunca ili manjih
Niz proton-proton
prevladava kod zvijezdi veli?ine na?eg Sunca ili manjih
Elementarni vodik na Zemlji je vrlo rasprostranjen, ali u malim koli?inama. Nazo?an je u
atmosferi
,
zemnom plinu
, vulkanskim plinovima, itd. Zbog toga ?to ga gravitacija te?ko mo?e zadr?ati, vodik u gornjim dijelovima atmosfere izlazi u svemir.
U obliku spojeva, ima ga u ogromnim koli?inama, ponajvi?e u obliku
vode
, koja prekriva gotovo dvije tre?ine Zemljine povr?ine. Sastavni je dio mnogih
organskih spojeva
,
kiselina
i
otopina
. Po broju atoma, tre?i je, odmah nakon kisika i silicija, a po masenom udjelu je na desetom mjestu.
?ini 75% mase
svemira
, te je ishodi?na tvar iz koje su
nuklearnom fuzijom
nastali ostali elementi. Po broju atoma, vodika ima 90% u svemiru. Ima ga u ogromnim koli?inama u
zvijezdama
i
plinovitim divovima
, a izgleda da ga ima u jo? neotkrivenoj
tamnoj tvari
i
tamnoj energiji
. Molekularni oblaci sa H
2
su povezani sa rođenjem zvijezda. Vodik ima odlu?uju?u ulogu u stvaranju snage i toplinske energije u
nuklearnoj fuziji
, koja se odvija u jezgrama zvijezda, kroz
niz proton ? proton
i
niz ugljik ? du?ik ? kisik
.
[9]
[10]
U svemiru vodik se uglavnom nalazi u atomskom stanju ili kao
plazma
, ?ija su svojstva sasvim druk?ija od molekularnog vodika H
2
. Kao plazma, vodikovi elektroni i protoni nisu povezani zajedno, i stvaraju veoma jaku
elektri?nu vodljivost
i veliku emisiju
topline
(stvara
elektromagnetsko zra?enje
, uklju?uju?i svjetlost sa
Sunca
i ostalih
zvijezda
). Na nabijene ?estice vodika sna?no utje?u
magnetska
i
elektri?na polja
. Na primjer,
Sun?ev vjetar
djeluje na Zemljinu
magnetosferu
, stvaraju?i
polarnu svjetlost
i Birkelandovu struju.
[11]
Pod normalnim uvjetima na Zemlji, vodik se uglavnom nalazi kao plinovita molekula H
2
. Ustvari, vodikov plin je vrlo rijedak u atmosferi, svega 0,000055%, zato ?to je molekula vodika puno lak?a od zraka, zbog ?ega lak?e bje?i iz
atmosfere
. Ipak, na Zemljinoj povr?ini, vodik je tre?i najra?ireniji element, uglavnom u obliku molekula
vode
i
ugljikohidrata
. Neke
alge
i
bakterije
stvaraju plin vodik.
[12]
Naj?e??e se dobiva onako kako ga je prvi put dobio Cavendish, tj. reakcijom cinka i klorovodi?ne kiseline, umjesto koje se ?esto rabi i razrijeđena
sumporna kiselina
:
Zn
(s)
+ 2 H
+
→ Zn
2+
+ H
2(g)
Za razvijanje plinova u laboratoriju najpogodniji je
Kippov aparat
, jer se reakcija u njemu mo?e prekinuti i na taj na?in proizvesti samo potrebne koli?ine plina.
Mo?e se dobiti i reakcijom vode s ?vrstim
hidridima
, kao ?to je
kalcijev hidrid
:
2 H
2
O + CaH
2(s)
→ 2 H
2(g)
+ Ca
2+
+ 2 OH
-
te reakcijom metala negativnog redukcijskog potencijala s
lu?inama
, ako ti metali stvaraju hidrokso-komplekse:
2 Al
(s)
+ 6 H
2
O + 2 OH
-
→ 2 Al(OH)
4
-
+ 3 H
2(g)
Ovisno o cijeni elektri?ne energije i energenata, vodik se dobiva na nekoliko na?ina.
U zemljama s jeftinom elektri?nom energijom, dobiva se elektrolizom vode, zalu?ene alkalijskim hidroksidom zbog pove?anja vodljivosti:
- katoda
(-): 4 H
2
0 + 4e
-
→ 2 H
2(g)
+ 4 OH
-
- anoda
(+): 4 OH
-
→ O
2(g)
2 H
2
O + 4e
-
- 2 H
2
O → 2 H
2(g)
+ O
2(g)
Vodik se dobiva i kao nusprodukt kod dobivanja
klora
metodom
kloralkalne elektrolize
.
Jedna od najra?irenijih i najjeftinijih metoda jest piroliza ugljikovodika, primjerice
etana
:
C
2
H
2(g)
→ C
2
H
4(g)
+ H
2(g)
Kada je lako dostupan
metan
, koristi se njegova reakcija s vodenom parom na 1100 °C:
CH
4(g)
+ H
2
O ? CO
(g)
+ 3 H
2(g)
 = 214.4 kJ mol
-1
= 214.4 kJ mol
-1
Kada je lako dostupan i jeftin ugljen, koristi se redukcija vodene pare:
C
(s)
+ H
2
O ? CO
(g)
+ H
(g)
 = 131.25 kJ mol
-1
= 131.25 kJ mol
-1
 Bioreaktor sa algama za proizvodnju vodika
Bioreaktor sa algama za proizvodnju vodika
Dobivena smjesa zove se
vodeni plin
.
Ugljikov(II) oksid
od vodika se odvaja reakcijom s dodatnom vodenom parom, pri ?emu nastaje dodatna koli?ina vodika:
CO
(g)
+ H
2
O
(g)
→ H
2(g)
+ CO
2(g)
Nastali
ugljikov(IV) oksid
uklanja se iz smjese apsorpcijom u lu?ini ili ispiranjem vodom pod tlakom. Lako se uklanja i hlađenjem teku?im zrakom. Tragovi neizreagiranog
ugljikovog(II) oksida
uklanjaju se prevođenjem plina preko zagrijanog
natrijevog hidroksida
pri ?emu nastaje
natrijev metanoat
.
Postoji vi?e od 200 termokemijskih procesa, koji se mogu iskoristiti za razdvajanje vode. Oko 10-tak procesa se istra?uje i ispituje za dobivanje vodika i
kisika
iz
vode
, te grijanjem bez upotrebe
elektri?ne struje
, a ti su procesi na primjer: ciklus
?eljeznog
oksida, ciklus
cerij
(IV) oksid - cerij (III) oksid, ciklus
cink
? cink oksid, ciklus
sumpor
?
jod
, ciklus
bakar
?
klor
i ciklus hibridni
sumpor
. Veliki broj labaratorija u Francuskoj, Njema?koj, Gr?koj, Japanu i SAD razvijaju termokemijske procese uz kori?tenje Sun?eve energije i vode.
[13]
[14]
 U spremniku je tamno zeleni ?eljezo(II) hidroksid ili zelena korozija
U spremniku je tamno zeleni ?eljezo(II) hidroksid ili zelena korozija
Bez prisustva kisika,
?eljezo
i legirani
?elik
polako
oksidiraju
uz pomo?
protona
iz vode, koji se pretvaraju u plinoviti vodik H
2
. Anaerobna korozija stvara prvo ?eljezni hidroksid (zelena korozija) i ta se kemijska reakcija mo?e opisati kao:
- Fe + 2 H
2
O → Fe(OH)
2
+ H
2
U drugom koraku, bez prisustva kisika, ?eljezni hidroksid mo?e oksidirati uz pomo? protona iz vode i stvoriti
magnetit
i plinoviti vodik. Taj se proces naziva Shikorrova reakcija:
- 3 Fe(OH)
2
→ Fe
3
O
4
+ 2 H
2
O + H
2
Dobro kristalizirani magnetit (Fe
3
O
4
) je termodinami?ki puno stabilniji od ?eljeznog hidroksida. Taj se proces obi?no de?ava za vrijeme anaerobne korozije ?eljeza i ?elika, u
podzemnim vodama
koje nemaju kisika, i u reduciranim
tlu
u kojem ima dosta vlage.
Bez prisustva kisika, u dubokim geolo?kim slojevima, koji su daleko od Zemljine atmosfere, plinoviti vodik se stvara za vrijeme procesa
serpentacije
, ?to je anaerobna oksidacija protona vode (H
+
) i ?eljeznog (Fe
2+
)
silikata
, koji je prisutan u kristalima fajalita (Fe
2
SiO
4
? krajnji ?lan
olivina
). Ta reakcija vodi do stvaranja
magnetita
(Fe
3
O
4
),
kvarca
(SiO
2
) i vodika (H
2
), na slijede?i na?in:
3 Fe
2
SiO
4
+ 2 H
2
O → 2 Fe
3
O
4
+ 3 SiO
2
+ 3 H
2
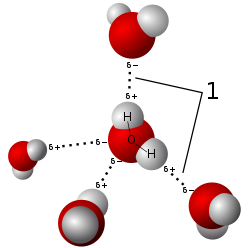 Model vodikovih veza (1) kod molekula
vode
.
Model vodikovih veza (1) kod molekula
vode
.
Spojevi vodika mogu se podijeliti na spojeve u kojima je nazo?an u negativnom (-1) i pozitivnom stupnju oksidacije (+1).
Prvi se nazivaju
hidridima
, i zauzimaju manjinu vodikovih spojeva, dok su drugi puno zastupljeniji i va?niji. Sastavni je dio ?ivog svijeta, u kojem igra jednu od temeljnih uloga.
Poznati spojevi su vodikov peroksid i vodikov praskavac.
Na sobnoj temperaturi nije previ?e reaktivan, no pri vi?im temperaturama ulazi u niz reakcija. Poznati su milijunu
ugljikovodika
, koji su podru?je prou?avanja organske kemije. Vodik stvara spojeve i sa elementima koji imaju ve?u elektronegativnost, kao ?to su
halogeni elementi
(F, Cl, Br, I). Kada se spaja sa
fluorom
,
kisikom
ili
du?ikom
, vodik se mo?e vezati u jakoj nekovalentnoj vezi, koja se zove
vodikova veza
, koja je kriti?na u stabilnosti mnogih biolo?kih molekula. Vodik se ve?e i sa manje elektronegativnim elementima, kao ?to su
metali
i
polumetali
.
Hidridi
su spojevi raznih kemijskih elemenata s vodikom. S-blok ?ine elementi prve i druge skupine periodnog sustava elemenata. P-blok ?ine elementi 13. - 17. skupine periodnog sustava elemenata. To su najva?niji hidridi, ?esto kori?teni u praksi. Dijele se na kisele, bazne, amfoterne i neutralne. Kiseli hidridi su oni hidridi koji u reakciji s vodom daju kiseline. Bazni hidridi su oni hidridi koji u reakciji s vodom daju baze. Amfoterni hidridi, ovisno o reakciji, mogu se pona?ati i kao kiseline i kao baze. Neutralni hidridi uop?e ne reagiraju s vodom
 Sat sa luminiscentnom bojom od tricija
Sat sa luminiscentnom bojom od tricija
Elementarni vodik sastoji se od
obi?nog vodika (procija)
(>99,98%), dok ostatak (gotovo 0,02%) ?ini
te?ki vodik (deuterij)
s tragovima
superte?kog vodika (tricija)
.
- 1H ili
procij
je daleko naj?e??i izotop vodika, kojeg ima vi?e od 99,98%. Ima jedan
proton
i jedan
elektron
. Za razliku od svih ostalih izotopa, nema
neutron
.
- 2H ili
deuterij
, ima jedan proton i jedan neutron u jezgri, te jedan elektron. U biti, vjeruje se da sav deuterij u svemiru potje?e jo? od vremena
Velikog praska
i da jo? traje. Deuterij nije radioaktivan, i ne prestavlja zna?ajnu opasnost za zdravlje. On se koristi i kod nuklearne magnetno rezonantne
spektroskopije
, za ozna?avanje neradioaktivnih tvari u otapalu. Voda koja uklju?uje atome deuterija se naziva
te?ka voda
. Te?ka voda se koristi u
nuklearnim reaktorima
za smanjivanje brzine brzih
neutrona
, kao i za hlađenje nuklearnih reaktora. Deuterij prestavlja mogu?e gorivo za dobivanje
elektri?ne energije iz nuklearne fuzije
.
- 3H ili
tricij
, ima jedan proton i dva neutrona u jezgri, te jedan elektron.Tricij je radioaktivan, raspada se u
helij
-3 izotop, uz pojavu
beta-?estica
i ima
vrijeme poluraspada
od 12,32 godine. Toliko je radioaktivan da se koristi za
luminiscentne
boje, koje se koriste i kod satova, kod kojih se mo?e vidjeti vrijeme i u mraku. Staklo sprije?ava da mala koli?ina radioaktivnosti izađe van. U prirodi se tricij mo?e na?i u vrlo malim koli?inama u
atmosferi
, a nastaje uslijed djelovanja
kozmi?kih zraka
. Tricij mo?e nastati kod testiranja
nuklearnog oru?ja
. Tricij prestavlja mogu?e gorivo za dobivanje
elektri?ne energije iz nuklearne fuzije
. On se koristi kod kemijskih i biolo?kih pokusa kao radioaktivni ozna?iva?.
Vodik je jedini kemijski element ?iji se izotopi ozna?uju drugim imenima (procij, deuterij, tricij).
Međunarodna unija za ?istu i primijenjenu kemiju
dozvoljava oznake D za deuterij ili T za tricij, ali preporu?uje oznake
2
H and
3
H. Oznaka P se ve? koristi za
fosfor
, tako da se ne mo?e koristiti za procij.
Prilikom ispitivanja vibracijsko-rotacijskog spektra vodika pronađene su promjene u intenzitetu rotacijskih vrpci, koje su protuma?ene hipotezom o postojanju dva oblika vodika koji se razlikuju po nuklearnim spinovima u molekuli vodika. Ako su spinovi dvaju protona iz molekule antiparalelni, rezultantni spin je nula, te je stanje nedegenerirano. Takav vodik zove se para-vodik. Ako su paralelni, rezultantni spin je 1, a stanje je trostruko degenerirano, ?to dovodi do orto-vodika.
Pri sobnoj temperaturi, elementarni se vodik sastoji od 75% orto-vodika i 25% para-vodika. Orto- i para-vodik razlikuju se po nekim fizikalnim svojstvima, primjerice energiji disocijacije, toplinskom kapacitetu, tlaku para i sli?no.
Između njih postoji ravnote?a:
o
-H
2
?
p
-H
2
 < 0
< 0
koja se hlađenjem pomi?e udesno.
Na niskim temperaturama mogu?e je izolirati gotovo ?isti para-vodik, no ?isti orto-vodik nije mogu?e izolirati, jer pove?anjem temperature ne dolazi do pove?anja njegovog udjela iznad 75%.
Odnos između orto- i para-vodika je vrlo bitna kod spremanja teku?eg vodika u spremnik, jer pretvaranje orto-vodika u para-vodik stvara dodatno toplinu, koja mo?e dovesti do hlapljenja, a time i gubitka teku?eg vodika. Zbog toga treba koristiti
katalizatore
, kao ?to je
?eljezov (III) oksid
, aktivni
ugljik
, platinizirani
azbest
,
kovine rijetkih zemalja
,
uranovi
spojevi,
kromov
oksid i neki spojevi
nikla
.
Molekularni oblik iona triatomnog vodika ili H
3+
, je pronađen u međuzvjezdanoj materiji, koji je nastao ionizacijom vodika sa
kozmi?kim zrakama
. Također, taj oblik molekule je pronađen u gornjoj atmosferi
Jupitera
. Ona je dosta stabilna u tim okolinama, zbog malih temperatura i gusto?e. To je jedan od najra?irenijih
iona
u svemiru.
Vodik je vrlo va?na industrijska sirovina. Koristi se, između ostalog, za sintezu
amonijaka
i
metanola
, za proizvodnju goriva za motorna vozila hidrogenacijom ugljika,
nafte
i
katrana
. Koristi se i za zavarivanje i taljenje
metala
, za punjenje zra?nih balona i zra?nih brodova, za redukciju metalnih
oksida
u metale, hidrogeniranje ulja u masti itd.
Radi se na kori?tenju vodika kao goriva. Tehnologija je vrlo slabo rasprostranjena.
Prednosti vodika kao goriva su:
- visoka energetska vrijednost
- neograni?ene koli?ine dostupne u spojevima
- izgaranjem daje kemijski ?istu vodu
- cjevovodima se mo?e razvoditi na daljinu
- lak?e se skladi?ti i ?uva nego elektri?na energija
Nedostaci koji sprje?avaju ra?ireniju uporabu su:
- visoka cijena i ?esto slaba isplativost izvla?enja vodika iz spojeva
- obilno curenje vodika kroz spremnike i cjevovode, zbog ekstremo malene molekule
- vodik difundiranjem u razne metale naru?ava njihovu kristalnu re?etku ?ine?i ih krtima
- opasnost za ozonski sloj jer trenutno reducira ozon u vodu
U kemijskom smislu, vodik nije izvor, ve? spremnik energije, jer nije prirodno nabavljiv u elementarnom obliku. U slu?aju uspje?ne i odr?ive nuklearne fuzije u
nuklearnoj elektrani
, bio bi izvor ogromnih koli?ina energije.
Velike koli?ine H
2
se koriste u naftnoj i kemijskoj industriji. Najve?a primjena je kod pobolj?anja
fosilnih goriva
i u proizvodnji
amonijaka
. U petrokemiji H
2
se koristi u procesima kao ?to su: hidrokrekiranje, kataliti?ko reformiranje benzina, izomerizacija i alkilacija. H
2
se isto koristi u pove?anju zasi?enja nezasi?enih masti i ulja (koristi se za dobivanje
margarina
). Također je sirovina za dobivanje
klorovodi?ne kiseline
, a koristi se i kao
reducens
za
mineralne sirovine
ili rude.
[15]
Vodik je izuzetno topiv u mnogim
kovinama rijetkih zemalja
i
prijelaznim metalima
, a topiv je i u nanokristalima i amorfnim metalima.
Topljivost
u metalima utje?e na lokalne deformacije ili ne?isto?e u
kristalnim re?etkama
, tako da metali postaju krtiji i lomljiviji, ?to stvara velike probleme u
metalurgiji
, u izradi cjevovoda i metalnih rezevoara. Ponekad se to mo?e rije?iti ako vodik se pro?isti prolaskom kroz diskove
paladija
.
[16]
Plinoviti vodik H
2
se koristi za hlađenje rotora
elektri?nih generatora
u
elektranama
, zato ?to ima najve?u toplinsku provodljivost od svih plinova. Teku?i H
2
se koristi u ispitivanju
supravodljivosti
kod vrlo niskih temperatura. Budu?i da je plinoviti vodik H
2
skoro 15 puta lak?i od zraka, nekad se koristio za
balone na vru?i zrak
.
U novije vrijeme, plinoviti vodik H
2
se mije?a sa
du?ikom
, za dobivanje
formiraju?eg plina
(oko 5% vodika u du?iku), koji se koristi kod postupka lociranja ili utvrđivanja propu?tanja kod raznih cjevovoda u automobilskoj, kemijskoj industriji, elektranama, zrakoplovstvu i telekomunikacijama. Vodik se koristi kao dodatak
hrani
(E 949) za provjeru konzervirane hrane.
[17]
Trojna to?ka
vodika u ravnote?i iznosi 13, 8033 Kelvina.
 Mercedes-Benz O530 Citaro autobus kojeg pogone vodikove
gorive ?elije
, u
Brno
,
?e?ka
.
Mercedes-Benz O530 Citaro autobus kojeg pogone vodikove
gorive ?elije
, u
Brno
,
?e?ka
.
Vodik nije izvor energije, osim u mogu?im elektranama na
nuklearnu fuziju
, koje bi koristile
deuterij
i
tricij
, ?to je jo? daleko od komercijalne upotrebe. Vodik koji se dobije iz sun?evih, biolo?kih ili elektri?nih izvora, treba vi?e energije nego ?to od njega mo?emo dobiti izgaranjem, zato on vi?e ima ulogu kao
baterija
, za spremanje ili skladi?tenje energije. Vodik se mo?e dobiti iz
metana
, ali ti se izvori nazivaju neodr?ivim izvorima energije.
[18]
Gusto?a energije
po jedinici obujma, za teku?i ili komprimirani vodik, je puno manja od poznatih fosilnih goriva, iako po jedinici mase, gusto?a energije je ve?a. Ipak, o vodiku se dosta raspravlja kao o budu?em nosiocu energije. Tako recimo, vezivanjem ugljikovog dioksida iz zraka, mo?e biti povezano sa stvaranjem H
2
kao fosilnog goriva. Tada bi vodik bio relativno ?isti izvor energije, uz malo ispu?tanje
du?ikovih oksida
, ali bez stvaranja
ugljikovog dioksida
. Ipak, ulaganje u infrastrukturu bi bilo znantno.
[19]
U proizvodnji
poluvodi?a
, vodik se koristi za zasi?enje slomljenih (“klimavih”) veza u amorfnom
siliciju
i amorfnom
ugljiku
, da bi im se pove?ala kvaliteta. On je isto mogu?i dodatak u razli?itim oksidima, kao: ZnO, SnO
2
, CdO, MgO, ZrO
2
, HfO
2
, La
2
O
3
, Y
2
O
3
, TiO
2
, SrTiO
3
, LaAlO
3
, SiO
2
, Al
2
O
3
, ZrSiO
4
, HfSiO
4
i SrZrO
3
.
[20]
Kao sastojak vode, nalazi se u svakom biolo?kom organizmu u velikim koli?inama. Osim u vodi, nalazi se i u gotovo svim organskim spojevima unutar organizma, vezan kovalentno za primjerice
ugljik
ili
du?ik
. U vodenim otopinama koje su dio svakog organizma, nazo?an je u obliku H
3
O
+
iona, te kao takav ima izvanredno va?nu, temeljnu ulogu u regulaciji stani?nih procesa.
H
2
se stvara kod nekih vrsta
vrenja ili fermentacija
, a stvaraju ga neki
mikroorganizmi
, obi?no uz pomo?
katalizatora
, koje sadr?e
enzime
sa
?eljezom
ili
niklom
, koji se nazivaju hidrogenaze.
Razdvajanje vode u protone, elektrone i kisik, javlja se kod gotovo svih biljaka koje vr?e
fotosintezu
. Neki takvi organizmi, kao
modrozelene alge
su razvile i drugi korak, po mraku, kojim se stvara plinoviti vodik H
2
uz pomo? specijalnih hidrogenaza u
kloroplastu
. Trenutno se rade ispitivanja na genetski modificiranim modrozelenim algama, koje bi stvarale H
2
, ?ak i u prisustvu kisika ili takozvani
bioreaktori
.
[21]
Vodik stvara ?itav niz opasnosti za ?ovjekovu sigurnost, pogotovo H
2
je opasan kao plin praskavac u zraku. Osim toga, teku?i vodik je opasan, jer stvara vrlo niske temperature, ?to mo?e dovesti do smrzotina na prstima.
[22]
-
Chart of the Nuclides
(17th izd.). Knolls Atomic Power Laboratory. 2010.
ISBN
978-0-9843653-0-2
.
- Ferreira-Aparicio, P; Benito, M. J.; Sanz, J. L. (2005). ?New Trends in Reforming Technologies: from Hydrogen Industrial Plants to Multifuel Microreformers”.
Catalysis Reviews
47
(4): 491?588.
DOI
:
10.1080/01614940500364958
.
- Newton, David E. (1994).
The Chemical Elements
. New York: Franklin Watts.
ISBN
0-531-12501-7
.
- Rigden, John S. (2002).
Hydrogen: The Essential Element
. Cambridge, Massachusetts: Harvard University Press.
ISBN
0-531-12501-7
.
- Romm, Joseph, J. (2004).
The Hype about Hydrogen, Fact and Fiction in the Race to Save the Climate
. Island Press.
ISBN
1-55963-703-X
.
- Scerri, Eric (2007).
The Periodic System, Its Story and Its Significance
. New York: Oxford University Press.
ISBN
0-19-530573-6
.