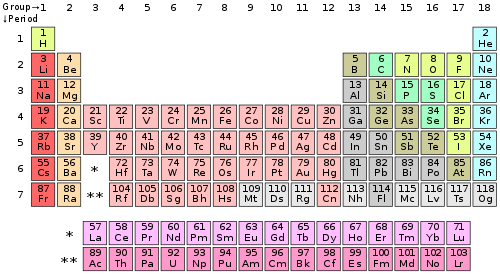
 Standardna forma periodne tabele
Standardna forma periodne tabele
Periodni sistem elemenata
je tabelarni prikaz
hemijskih elemenata
, organizovanih na osnovu njihovih
atomskih brojeva
(broja
protona
u
jezgru
),
elektronskoj konfiguraciji
i ponavljaju?im
hemijskim osobinama
.
[1]
[2]
[3]
Elementi su poređani po rastu?em atomskom broju, koji se obi?no navodi sa
hemijskim simbolom
u svakom polju. Standarni oblik tabele se sastoji od mre?e elemenata poređanih u 18 kolona i 7 redova, sa dva reda elemenata ispod te tabele. Tabela se mo?e podeliti na ?etiri pravougaona
bloka
:
s-blok
nalevo,
p-blok
nadesno,
d-blok
u sredini i
f-blok
ispod njega.
Vrste tabele se nazivaju
periode
, a kolone se nazivaju
grupe
, a neke od kolona imaju posebna imena kao ?to su
halogeni elementi
ili
plemeniti gasovi
. Po?to je po definiciji periodni sistem zasnovan na ponavljaju?im trendovima, svaka takva tabela se mo?e koristiti da se dobiju veze između osobina elemenata i predvide osobine novih, jo? neotkrivenih ili sintetizovanih elemenata. Zbog toga periodni sistem elemenata, bez obzira da li je u standarnom obliku ili u nekoj drugoj varijanti, pru?a koristan okvir za analizu hemijskog pona?anja i ?iroko se upotrebljava u
hemiji
i u drugim naukama.
Iako su postojale prethodnice periodnog sistema,
Dmitriju Mendeljejevu
se uglavnom pripisuju zasluge za objavljivanje prve tabele ?iroko priznatog periodnog sistema elemenata 1869. godine. On je razvio svoj periodni sistem da ilustruje periodi?ne trendove u osobinama tada poznatih elemenata. Mendeljejev je takođe predvideo neke osobine tada nepoznatih elemenata od kojih se o?ekivalo da popune rupe u njegovoj tabeli. Ve?ina njegovih predviđanja se pokazala ta?nom kada su doti?ni elementi kasnije otkriveni. Mendeljejevljev periodni sistem je od tada pro?irivan i pobolj?an
otkri?em ili sintetizovanjem novih elemenata
i razvojem novih teoretskih modela za obja?njenje hemijskih odlika.
Svi elementi od atomskih brojeva 1 (
vodonik
) do 118 (
ununoktijum
) su otkriveni ili navodno sintezizovani, dok se elementi 113, 115, 117 i 118 jo? uvek moraju potvrditi. Prvih 98 elemenata postoje u prirodi, mada se neki mogu prona?i samo u tragovima ili su sintetizovani u laboratorijama pre nego ?to su pronađeni u prirodi. Elementi sa atomskim brojevima od 99 do 118 su samo sintetizovani ili se tvrdi da su sintetizovani. Dobijanje elemenata koji imaju ve?e atomske brojeve je izazov, dok se postavlja pitanje koliko se periodni sistem elemenata mo?e modifikovati da se zadovolje bilo kakvi novi dodaci.
Zna?enje boja atomskih brojeva:
- Elementi numerisani brojem obojenim u
plavu boju
su u te?nom agregatnom stanju na
standardnoj temperaturi i standardnom pritisku
(STP).
- numerisani brojem obojenim u
zeleno
su gasovitom agregatnom stanju na STP;
- numerisani brojem obojenim u
crno
su u ?vrstom agregatnom stanju na STP;
- numerisani brojem obojenim u
crveno
su
ve?ta?ki
(svi su u ?vrstom agregatnom stanju na STP).
- numerisani brojem obojenim u
sivo
jo? uvek nisu otkriveni (takođe imaju posvetljenu boju koja prikazuje u koju grupu hemijskih elemenata spadaju).
Sve verzije periodnog sistema obuhvataju samo hemijske elemente, a ne
sme?e
jedinjenja
, ili
subatomske ?estice
.
[n 1]
Svaki hemijski element ima jedinstveni atomski broj koji ozna?ava broj protona u njegovom jezgru. Ve?ina elemenata ima razli?ite brojeve
neutrona
u razli?itim atomima, pri ?emu se te varijante nazivaju
izotopima
. Na primer, ugljenik ima tri prirodna izotopa: svi njegovi atomi imaju ?est protona i ve?ina ima ?est neutrona, ali oko jednog procenta ima sedam neutrona, i veoma mala frakcija ima osam neutrona. Izotopi se nikad ne razdvajaju u periodnom sistemu; oni se uvek zajedno grupi?u kao jedan element. Elementi koji nemaju stabilne izotope imaju atomske mase najstabilnijih izotopa, i takve mase su navedene u zagradama.
[4]
U standardnom periodnom sistemu, elementi su poređani po atomskom broju (broju
protona
u
jezgru
atoma). Novi red (
perioda
) se po?inje kad nova elektronska ljuska ima svoj prvi elektron. Kolone (
grupe
) su određene
elektronskom konfiguracijom
atoma; elementi sa istim brojem elektrona u određenoj podljusci padaju u iste kolone (e.g.
kiseonik
i
selen
su u istoj koloni zato ?to oba imaju ?etiri elektrona u krajnjoj p-podljusci). Elementi sa sli?nim hemijskim svojstvima generalno padaju u istu grupu periodnog sistema, mada u f-bloku, i donekle u d-bloku, elementi u istoj periodi isto tako imaju sli?na svojstva. Stoga je relativno lako da se predvide hemijske osobine elementa ako se znaju svojstva jednog od elemenata u njegovoj blizini.
[5]
Godine 2014. periodni sistem je imao 114 potvrđena elementa, ?ime su obuhva?eni: 1 (vodonik) do 112 (
kopernicijum
), 114 (
flerovijum
) i 116 (
livermorijum
). Elementi 113, 115, 117 i 118 su navodno sintetizovani u laboratorijama međutim te tvrdnje nisu zvani?no potvrđene od strane
Međunarodne unije za ?istu i primenjenu hemiju
(IUPAC), niti su im data imena. Kao takvi ovi elementi su trenutno nazivaju po njihovom atomskim brojevima (e.g., "element 113"), ili njihovim provizionim
sistematskim imenima
("
ununtrijum
", simbol "Uut").
[6]
Ukupno 98 elemenata se prirodno javlja; preostalih 16 elemenata, od
ajn?tajnijuma
do
kopernicijuma
, i flerovium i livermorijum, se javljaju samo nakon laboratorijske sinteze. Od 98 prirodnih elemenata, 84 su
primordijalna
. Drugih 14 prirodnih elemenata se javljaju jedino u lancu raspadanja primordijalnih elemenata.
[7]
Element te?i od ajn?tajnijuma (elementa 99) nikad nije uo?en u makroskopskim koli?inama u svojoj ?istoj formi.
[8]
| Periodic table layouts
|
 Periodni sistem sa odvojenim f-blokom Periodni sistem sa odvojenim f-blokom
|
 Periodni sistem sa umetnutim f-blokom Periodni sistem sa umetnutim f-blokom
|
| Lantanoidi i aktinoidi su odvojeni (levo; 18 kolona) i u glavnoj tabeli (desno; 32 kolone)
|
U ve?ini grafi?kih prezentacija periodnog sistema, glavna tabela ima 18 kolona i
lantanoidi
i
aktinoidi
su prikazani kao dva dodatna reda ispod glavne tabele,
[9]
sa dva rezervisana mesta prikazana u glavnoj tabeli, između
barijuma
i
hafnijuma
, i
radijuma
i
raderfordijuma
, respektivno. Ovi dr?a?i mesta mogu dda budu markeri poput asteriska, ili sa?eti opisi elemenata ("57–71"). Ta konvencija je u potpunosti stvar prakti?nog formatiranja. Ista struktura tabele mo?e da bude prikazana u formatu sa 32 kolone, pri ?emu su lantanidi i aktinoidi u redovima 6 i 7 glavne tabele.
Međutim, na bazi hemijskih i fizi?kih svojstava elemenata mogu se konstruisati tabele sa mno?tvom alternativnih struktura.
Grupa
ili
familija
je vertikalna kolona u periodnom sistemu. Grupe obi?no imaju zna?ajnije periodi?ne trendove od perioda i blokova, kao ?to je obja?njeno u daljem tekstu. Moderne kvantno mehani?ke teorije atomskih struktura obja?njavaju trendove grupa ?injenicom da elementi unutar iste grupe generalno imaju iste elektronske konfiguracije u njihovoj
valentnoj ljusci
.
[10]
Konsekventno, elementi u istoj grupi imaju sli?na hemijska svojstva i manifestuju jasan trend u osobinama sa porastom atomskog broja.
[11]
Međutim u nekim delovima periodnog sistema, kao ?to su d-blok i f-blok, horizontalne sli?nosti mogu da budu jednako va?ne, ili vi?e izra?ene od vertikalnih sli?nosti.
[12]
[13]
[14]
Po međunarodnoj imenskoj konvenciji, grupe se numeri?u od 1 do 18 sa leve strane (od alkalnih metala) do krajnje desne kolone (plemenitih gasova).
[15]
Ranije su bili kori??eni
rimski brojevi
. U Americi, rimskim brojevima je dodavano "A" ako je grupa u
s-
ili u
p-bloku
, ili "B" ako je grupa u
d-bloku
. Rimski brojevi su odgovarali zadnjoj cifri u dana?njoj imenskoj konvenciji (e.g.
elementi grupe 4
su bili grupa IVB, a
elementi grupe 14
su bili grupa IVA). U Evropi je kori?teno sli?no obele?avanje, izuzev da je "A" kori??eno ako je grupa bila pre
grupe 10
, a "B" je kori?teno za grupe uklju?uju?i i iza grupe 10. Dodatno grupe 8, 9 i 10 su tretirane kao triplet-grupa , kolektivno poznata u obe notacije kao grupa VIII. Godine 1988, novi IUPAC imenski sistem je u?ao u upotrebu, i ranije kori?tena imena grupa su postala zastarela.
[16]
Nekim od tih grupa su data trivijalna (nesistematska) imena, kao ?to je prikazano u donjoj tabeli, mada se pojedina retko koriste. Grupe 3?10 nemaju trivijalna imena i oslovljavaju se jednostavno po njihovim grupnim brojevima ili po imenu prvog ?lana grupe (kao ?to je 'scandijumova grupa' za
Grupu 3
), po?to one pozuju sli?nosti i/ili vertikalne trendove u manjoj meri.
[15]
Elementi u istoj grupi obi?no slede patern u pogledu
atomskog radijusa
,
energije jonizacije
, i
elektronegativnosti
. Idu?i od gore nadole u grupi, atomski radijusi elemenata se pove?avaju. Po?to broj popunjenih energijskih nivoa raste, valentni elektroni se nalaze sve dalje od nukleusa. Idu?i od gore na dole, svaki sukcesivni element ima sve manju energiju jonizacije jer je lak?e da se ukloni elektron. Sli?no tome, elementi grupe imaju idu?i od gore na dole sve manju elektronegativnost usled pove?anja rastojanja imeđu valentnih elektrona i nukleusa.
[17]
Postoje izuzeci tih trendova, na primer u
grupi 11
gde se elektronegativnost pove?ava idu?i nani?e.
[18]
Perioda
je horizontalni red u periodnoj tabeli. Mada grupe generalno imaju zna?ajnije periodi?ne trendove, postoje regioni gde su horizontalni trendovi zna?ajniji od trendova vertikalnih grupa, kao ?to je f-blok, u kom slu?aju
lantanoidi
i
aktinoidi
formiraju dve znatne horizontalne serije elemenata.
[19]
Elementi u istoj periodi ispoljavaju tredove u pogledu atomskog radijusa, energije jonizacije,
afiniteta elektrona
, i elektronegativnosti. Kre?u?i se sa leva na desno du? periode, atomiski radius se obi?no sni?ava. Do toga dolazi zato ?to svaki sukcesivni element ima dodatni proton i elektron ?to ima za posledicu pribli?avanje elektrona nukleusu.
[20]
Smanjenje atomskog radijusa uzrokuje povi?enje energije jonizacije idu?i s leva na desno du? periode. ?to ?vr??e je element vezan to je vi?e energije potrebno za uklanjanje elektrona. Elektronegativnost se povi?ava u istom maniru kao i energija jonizacije, zbog privla?enja elektrona od strane nukleusa.
[17]
Afinitet elektrona takođe pokazuje izvestan trend du? periode. Metali (na levoj strani periode) generalno imaju ni?i elektronski afinitet od nemetala (na desnoj strani periode), sa izuzetkom plemenitih gasova.
[21]
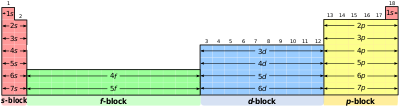 Sa leva na desno: s-, f-, d-, p-blok u periodnom sistemu
Sa leva na desno: s-, f-, d-, p-blok u periodnom sistemu
Specifi?ni regioni periodnog sistema se nazivaju
blokovima
u skladu sa redosledom u kom su elektronske ljuske elemenata popunjene. Blokovi su nazvani po podljusci u kojoj ?zadnji“ elektron teoretski boravi.
[22]
[n 2]
s-blok
se sastoji od prve dve grupe (alkalnih i zemnoalkalnih metala), kao i vodonika i helijuma.
p-blok
se sastoji od zadnjih ?est grupa, ?to su grupe 13 do 18 po IUPAC notaciji i sadr?i između ostalog, sve
metaloide
.
d-blok
se sastoji od grupa 3 do 12 i sadr?i sve
prelazne metale
.
f-blok
, koji se ?esto prikazuje ispod ostatka periodnog sistema, ne sadr?i numerisane grupe i obuhvata lantanoide i aktinoide.
[23]
 Metali,
metaloidi,
nemetali, i
elementi sa nepozatim hemijskim svojstvima u periodnom sistemu. Razli?iti izvori nisu saglasni po pitanju klasifikacije dela tih elemenata.
Metali,
metaloidi,
nemetali, i
elementi sa nepozatim hemijskim svojstvima u periodnom sistemu. Razli?iti izvori nisu saglasni po pitanju klasifikacije dela tih elemenata.
Na osnovu zajedni?kih fizi?kih i hemijskih svojstava, elementi se mogu klasifikovati u nekoliko kategorija:
metali
,
metaloidi
i
nemetali
. Metali su u op?tem slu?aju sjajne, visoko provodne ?vrste materije koje formiraju legure jedan s drugim, i jonska jedinjenja (soli) sa nemetalima (izuzev
plemenitih gasova
). Ve?ina nemetala su obojeni ili bezbojni izolacioni gasovi; nemetali koji formiraju jedinjenja sa drugim nemetalima ?ine to putem
kovalentnog vezivanja
. Između metala i nemetala su metaloidi, koji imaju srednja ili me?ovita svojstva.
[24]
Metali i nemetali se dalje mogu klasifikovati u potkategorije koje pokazuju gradijent od metalnih do nemetalnih svojstava, idu?i s leva na desno u periodnom redu. Metali se dalje dele u visoko reaktivne alkalne metale, manje reaktivne zemljoalkalne metale, lantanoide i aktinoide, arhetipske prelazne metala, i fizi?ki i hemijski slabe post-tranzicione metale. Nemetali se jednostavno dele u poliatomske nemetale, koji po?to su najbli?i metaloidima pokazuju donekle metalni karacter; diatomske nemetale, koji su esencijalno nemetalni; i monatomske plemenite gasove, koji su nemetalni i skoro kompletno inertni. Specijalizovana grupiranja kao ?to su
refraktorni metali
i
plemeniti metali
, koja su podskup (u ovom slu?aju) prelaznih metala, su isto tako poznata
[25]
i povremeno kori??ena.
[26]
Svrstavanje elemenata u kategorije i potkategorije na bazi zajedni?kih svojstava je imperfektno. Postoji ceo spektar svojstava u svakoj kategoriji i nije te?ko na?i preklapanja na granicama, kao ?to je to slu?aj i sa mnogim drugim klasifikacionim ?emama.
[27]
Berilijum
se, na primer, klasifikuje kao zemnoalkalni metal, mada njegova amfoterna hemija i tendencija da uglavnom formira kovalentna jedinjenja su atributi hemijski slabih ili post-tranzicionih metala.
Radon
se klasifikuje kao nemetal i plemeniti gas, iako on ima donekle katjonsku hemiju, koja je karakteristi?na za metale. Druge klasifikacione ?eme su mogu?e, kao ?to je podela elemenata u
mineralo?ke pojavne kategorije
, ili kristalizacione strukture. Kategorisanje elemenata na ovaj na?in datira jo? od 1869, kad je Hinrichs
[28]
napomenuo da jednostavne grani?ne linije mogu da budu povu?ene u periodnom sistemu radi ozna?avanja elemenata sa sli?nim svojstvima, kao ?to su metali i nemetali, ili gasoviti elementi.
 Aproksimativni redosled po kome su ljuske i podljuske organizovane u poledu pove?anja energije na osnovu
Madelungovog pravila
Aproksimativni redosled po kome su ljuske i podljuske organizovane u poledu pove?anja energije na osnovu
Madelungovog pravila
Elektronska konfiguracija ili organizacija elektrona koji orbitiraju neutralne atome ispoljava ponavljaju?i patern ili periodi?nost. Elektroni okupiraju serije
elektronskih ljuski
(numerisanih kao ljuska 1, ljuska 2, itd). Svaka ljuska se sastoji od jedne ili vi?e
orbitala
(imenovanih s, p, d, f i g). Sa porastom
atomskog broja
, elektroni progresivno popunjavaju te nivoe i orbitale, manje ili vi?e slede?i
Madelungovo pravilo
ili pravilo energetskog uređivanja, kao ?to je prikazano na dijagramu. Elektronska konfiguracija
neona
, na primer, je 1
s
2
2
s
2
2
p
6
. Sa atomskim brojem deset, neon ima dva elektrona na prvom nivou, i osam elektrona na drugom nivou ? dva u
s
orbitali i ?est u
p
orbitali. S perspektive periodnog sistema, kad prvi put elektron zauzme novi nivo, zapo?inje se nova perioda. Takve pozicije su zauzete
vodonikom
i
alkalnim metalima
.
[29]
[30]
 Trendovi periodnog sistema (strelice ozna?avaju pove?anja)
Trendovi periodnog sistema (strelice ozna?avaju pove?anja)
Po?to su svojstva elementa uglavnom određena njegovom elektronskom konfiguracijom, osobine elemenata takođe imaju ponavljaju?e ili periodi?ne trendove. Neki primeri toga su prikazani na donjim dijagramima za atomske radijuse, energiju jonizacije i elektronski afinitet. Manifestacije tih periodi?nih svojstava su bile
poznate daleko pre
razvoja
teorije
, i one su dovele do formulisanja zakona periodi?nosti (ponavljanja svojstava elemenata u variraju?im intervalima) i formulisanja prvih periodnih sistema.
[29]
[30]
Glavni ?lanak:
Atomski radijus
 Atomski radijus kao funkcija atomskog broja
[n 3]
Atomski radijus kao funkcija atomskog broja
[n 3]
Atomski radijusi variraju u predvidivom i obja?njivom maniru du? periodnog sistema. Na primer, radijusi se generalno smanjuju du? periode u tabeli, idu?i od alkalnih metala do plemenitih gasova; i pove?avaju se idu?i niz grupe. Radius se naglo pove?ava nakon plemenitog gasa na kraju svake periode i alkalnog metala na po?etku slede?e periode. Ovi trendovi atomskih radijusa (i raznih drugih hemijskih i fizi?kih svojstava elemenata) se mogu objasniti teorijom elektronskih nivoa atoma; oni pru?aju zna?ajnu evidenciju za razvoj i potvrđivanje
kvantne teorije
.
[31]
Elektroni u na 4f-podnivou, koji se progresivno popunjava idu?i od
cerijuma
(elementa 58) do
iterbijuma
(elementa 70), nisu posebno efektivni u za?ti?ivanju rastu?eg nuklearnog naelektrisanja iz isturenijih podnivoa. Elementi neposredno iza lantanoida imaju atomske radijuse koji su manji nego ?to bi o?ekivalo i koji su skoro identi?ni sa atomskim radijusima elemenata neposredno iznad njih.
[32]
Stoga
hafnijum
ima virtualno isti atomski radijus (i hemijska svojstva) kao
cirkonijum
, i
tantal
ima atomski radijus sli?an
niobijumu
, i tako dalje. Ova pojava je poznata kao
lantanoidna kontrakcija
. Efekat lantanidne kontrakcije je primetan do
platine
(elementa 78), nakon ?ega je maskiran
relativisti?kim efektom
poznatim kao
efekat inertnog para
.
[33]
Kontrakcija d-bloka
, koja je sli?na efektu između
d-bloka
i
p-bloka
, je manje izra?ena nego lantanoidna kontrakcija, mada proizilazi iz sli?nih uzroka.
[32]
 Energija jonizacije: svaki period po?inje sa minimumom za alkalne metale, i zavr?ava se maksimumom for the noble gases
Energija jonizacije: svaki period po?inje sa minimumom za alkalne metale, i zavr?ava se maksimumom for the noble gases
Prva energija jonizacije je energija koja je neophodna za uklanjanje prvog elektrona iz atoma, druga energija jonizacije je energija neophodna za uklanjanje drugog elektrona iz atoma, itd. Za dati atom, sukcesivne energije jonizacije se pove?avaju sa stepenom jonizacije. Veliki skokovi u uzastopnim molarnim energijama jonizacije se javljaju pri uljanjanju elektrona iz konfiguracije plemenitih gasova (kompletiranih elektronskih ljuski). Za magnezijum na primer, prva energija jonizacije je 738 kJ/mol, a druga je 1450 kJ/mol. Prve dve molarne energije jonizacije magnezijuma se odnose na uklanjanje dva 3
s
elektrona, a tre?a energija jonizacije bi bila daleko ve?a 7730 kJ/mol, jer bi se odstanjivao 2
p
elektron iz veoma stabilne konfiguracije Mg
2+
jona, koja je sli?na
neonu
. Istovetni skokovi se javljaju u energijama jonizacije u drugih atoma tre?e periode.
[33]
Elektroni u bli?im orbitalama su izlo?eni ve?im silama elektrostati?kog privla?enja; tako da je za njihovo uklanjanje potrebno vi?e energije. Energija jonizacije se pove?ava idu?i na gore i na desno u periodnom sistemu.
[33]
 Grafikon prikazuje porast elektronegativnosti sa porastom broja grupe
Grafikon prikazuje porast elektronegativnosti sa porastom broja grupe
Elektronegativnost je tendencija
atoma
da privla?i
elektrone
.
[34]
Elektonegativnost atoma je zavisna od njegovog
atomskog broja
i rastojanaja između
valentnih elektrona
i nukleusa. ?to je ve?a njegova elektronegativnost, to vi?e element privla?i elektrone. Ovo svojstvo je prvi predlo?io
Linus Pauling
1932. godine.
[35]
U op?tem slu?aju, elektronegativnost se pove?ava idu?i s leva na desno du? periode, i smanjuje se spu?tanjem niz grupe. Fluor najelektronegativniji element,
[n 4]
dok je
cezijum
najmanje elektronegativan, bar među elementima sa znatnom koli?inom dostupnih podataka.
[18]
Postoje neki izuzeci od ovog op?teg pravila.
Galijum
i
germanijum
imaju ve?u elektronegativnost od
aluminijuma
i
silicijuma
respektivno, zbog kontrakcije d-bloka. Elementi ?etvrte periode neposredno nakon prvog reda prelaznih metala imaju neobi?no male atomske radijuse zato ?to 3
d
- elektroni nisu efektivni u za?ti?ivanju naelektrisanja nukleusa, i manja veli?ina atoma je u korelaciji sa pove?anom elektronegativno??u.
[18]
Anomalno visoka elektronegativnost olova, posebno u odnosu na
talijum
i
bizmut
, ?ini se da je artefakt selekcije podataka (i dostupnosti podataka) ? metode ra?unja, izuzev Polingovog metoda, pokazuju normalne periodi?ne trendove za ove elemente.
[36]
 Zavisnot elektronskog afiniteta od atomskog broja.
[37]
Vrednosti se generalno pove?avaju du? svake periode, kulminiraju?i sa halogenima, pre naglog smanjenja kod plemenitih gasova. Primeri lokalizovanih pikova koji su uo?ljivi kod vodonika, alkalnih metala i
elemenata 11. grupe
su uzrokovani tendencijom kompletiranja
s
-orbitala (pri ?emu je 6
s
orbitala
zlata
dodatno stabilizovana relativisti?kim efektima i prisustvom popunjene 4f orbitale).
[38]
Zavisnot elektronskog afiniteta od atomskog broja.
[37]
Vrednosti se generalno pove?avaju du? svake periode, kulminiraju?i sa halogenima, pre naglog smanjenja kod plemenitih gasova. Primeri lokalizovanih pikova koji su uo?ljivi kod vodonika, alkalnih metala i
elemenata 11. grupe
su uzrokovani tendencijom kompletiranja
s
-orbitala (pri ?emu je 6
s
orbitala
zlata
dodatno stabilizovana relativisti?kim efektima i prisustvom popunjene 4f orbitale).
[38]
Elektronski afinitet atoma je koli?ina energije koja se oslobodi dodavanjem elektrona u neutralni atom, ?ime se formira negativni jon. Mada elektronski afinitet znatno varira, izvesni obrasci su primetni. Generalno,
nemetali
imaju pozitivnije vrednosti elektronskog afiniteta od
metala
.
Hlor
najja?e privla?i dodatni elektron. Elektronski afiniteti plemenitih gasova nisu nepobitno izmereni, tako da oni mo?da imaju neznatno negativne vrednosti.
[39]
Elektronski afinitet se generalno pove?ava du? periode. To je uzrokovano popunjavanjem valentne ljuske atoma; atom grupe 17 otpu?ta vi?e energije od atoma grupe 1 pri zadobijanju elektrona, zato ?to dobija popunjenu valentnu ljusku i stoga je stabilniji.
[39]
Trend smanjivanja elektronskog afiniteta idu?i niz grupe je logi?an. Dodatni elektron ulazi u orbitale koje su udaljenije od nukleusa. Kao takav taj elektron u manjoj meri privla?i nukleus i manje energije se otpu?ta njegovim dodavanjem. Međutim, pri kretanju nih grupe, oko jedne tre?ine elemenata pokazuje anomalna svojstva, pri ?emu te?i elementi imaju ve?e elektronske afinitete od njihovih susednih lak?ih kongenera. Ta pojava je uglavnom posledica nedovoljnog za?ti?ivanja
d
i
f
elektronima. Uniformno smanjenje elektronskog afiniteta je primetno jedino u 1. grupi atoma.
[40]
?to je ni?a vrednost energije jonizacije, elektronegativnosti i elektronskog afiniteta, to u ve?oj meri element ima
metalni
karakter. Nasuprot tome, nemetalni karakter se pove?ava sa pove?anjem vrednosti tih svojstava.
[41]
Imaju?i u vidu periodi?ne trendove te tri osobine, metalni karakter ima tendeciju opadanja du? periode (ili reda). Postoje izvesne iregularnosti, uglavnom zbog slabe za?tite nukleusa
d
i
f
elektronima, i
relativisti?kih efekata
.
[42]
Elementi sa najizra?enijim metalnim karakterom (poput
cezijuma
i
francijuma
) su u donjem levom uglu periodnog sistema, a nemetalni elementi (
kiseonik
,
fluor
,
hlor
) su prevashodno u gornjem desnom uglu. Kombinacija horizontalnih i vertikalnih trendova u ispoljavanju metalnog karaktera obja?njava rebrastu liniju podele između metala i nemetala u nekim periodnim sistemima, i praksu da se ponekad elementi pored te linije smatraju
metaloidima
.
[43]
[44]
Iako je sastavljanje periodnog sistema ne?to ?to se rutinski pripisuje
Mendeljejevu
, periodizacija i sistematizacija elemenata ima znatno du?u istoriju.
[1]
[2]
[3]
Ve? u 17. veku, ta?nije
1661
. godine,
Robert Bojl
je poređao tada poznatih 13
elemenata
po rastu?oj
relativnoj atomskoj masi
, dok ?e ovaj sistem pro?iriti
Lavoazje
sa dodatnih 11 elemenata.
Za ovo vreme zna?ajna otkri?a na polju hemije i fizike, omogu?ila su otkrivanje i imenovanje novih elemenata, tako da je potreba za klasifikacijom tog rastu?eg broja poznatih elemenata postajala sve o?iglednija.
Johan Debernajer
, kao odgovor na ovu potrebu, formira sistem elemenata koji su bili poređani u trijade, po zajedni?kim osobinama, i tako da relativna atomska masa srednjeg elementa trijade bude aritmeti?ka sredina gornjeg i donjeg. Sli?nu sistematizaciju dao je i francuz
de ?akankurtua
, koji je do?ao na ideju da elemente, po rastu?oj relativnoj atomskoj masi poređa u spiralu obmotanu oko valjka.
Svakako najozbiljni pomak ka dana?njem periodnom sistemu, pre Mendeljeva dao je
D?on Njulends
koji je prema ugledu na muzi?ke oktave, dao periodni sistem sa elementima poređanim u oktave, tako da se osobine periodi?no ponavljaju nakon svakih 7 elemenata. U vertikalnim kolonama, elementi su bili poređani po porastu
Ar
, dok su horizontalne vrste bile uslovljene sli?no??u u osobinama.
Ipak rad
Mendeljejeva
na periodzaciji elemenata ostao je zapam?en kao najva?niji, nemalo zato ?to je njegovo re?enje periodnog sistema zaista bilo najadekvatnije.
1869
. on daje prvu verziju periodnog sistema sa rasporedom elemenata sli?nim onom kod Njulendsa. Ovakav raspored Mendeljejev je uslovio zakonom periodi?nosti koji je dao po kome su
fizi?ke i hemijske osobine elemenata periodi?ne funkcije njihove relativne atomske mase
.
1871
. Mendeljev daje drugu, reformisanu verziju periodnog sistema koja se temeljila na izmeni koju je Mendeljejev napravio u zakonu periodi?nosti. Naime, on je primetio da su
osobine hemijskih elemenata zapravo periodi?ne funkcije njihovih
rednih brojeva
. Reformisani periodni sistem imao je elemente podeljene u vertikalne nizove -
grupe
- koje su sadr?ale elemente sli?nih osobina i horizontalne nizove -
periode
- koje su imale elemente poređane po rastu?em rednom broju, i u kojima su su osobine iz prethodnog niza periodi?no ponavljale. Grupa je u po?etku bilo 8, prvih 7 su imale podgrupe dok je osma bila podeljena u trijade. Perioda je bilo sedam, i sistem nije sadr?ao
plemenite gasove
. Mendeljejev je takođe predvideo postojanje elemenata sa drugim atomskim masama koji jo? nisu bili otkriveni, ali je na osnovu zakona periodi?nosti za njih ostavio odgovaraju?a mesta.
Danas se ova periodi?nost obja?njava periodi?no??u javljanja sli?nih elektronskih konfiguracija u odgovaraju?im atomima.
- ↑
Neke tabele sadr?e element nulu (i.e. szostancuja koja se sastoji samo od neutrona), mada to nije uobi?ajeno. Pogledajte na primer Hemijsku galakciju Filipa Stjuarta.
- ↑
Postoje jedna nedosljednost i neke nepravilnosti u ovoj konvenciji. Na primer,
helijum
je prikazan da je u p-bloku mada je zapravo element s-bloka, i d-podljuska u d-bloku je zapravo popunjena kad se dosegne grupa 11, umesto grupe 12.
- ↑
Plemeniti gasovi
,
astat
,
francijum
, i svi elementi te?i od
americijuma
su izostavljeni, jer podaci o njim nisu dostupni.
- ↑
Dok je fluor najelektronegativniji element po Paulingovoj skali, dok je
neon
najelektronegativniji element po drugim skalama, kao ?to je Alenova skala.
- ↑
1,0
1,1
Housecroft C. E., Sharpe A. G. (2008).
Inorganic Chemistry
(3rd izd.). Prentice Hall.
ISBN
978-0-13-175553-6
.
- ↑
2,0
2,1
Lide David R., ur. (2006).
CRC Handbook of Chemistry and Physics
(87th izd.). Boca Raton, FL: CRC Press. 0-8493-0487-3.
- ↑
3,0
3,1
Susan Budavari, ur. (2001).
The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals
(13th izd.). Merck Publishing.
ISBN
0-911910-13-1
.
- ↑
Greenwood, pp. 24?27
- ↑
Gray, p. 6
- ↑
Koppenol, W. H. (2002).
?Naming of New Elements (IUPAC Recommendations 2002)”
(PDF).
Pure and Applied Chemistry
74
(5): 787?791.
DOI
:
10.1351/pac200274050787
.
- ↑
Emsley, John (2011).
Nature's Building Blocks: An A-Z Guide to the Elements
(New izd.). New York, NY: Oxford University Press.
ISBN
978-0-19-960563-7
.
- ↑
Haire, Richard G. (2006). ?Fermium, Mendelevium, Nobelium and Lawrencium”. u: Morss; Edelstein, Norman M.; Fuger, Jean.
The Chemistry of the Actinide and Transactinide Elements
(3rd izd.). Dordrecht, The Netherlands: Springer Science+Business Media.
ISBN
1-4020-3555-1
.
- ↑
Gray, p. 11
- ↑
Scerri 2007, p. 24
- ↑
Messler, R. W. (2010).
The essence of materials for engineers
. Sudbury, MA: Jones & Bartlett Publishers. str. 32.
ISBN
0-7637-7833-8
.
- ↑
Bagnall, K. W. (1967). ?Recent advances in actinide and lanthanide chemistry”. u: Fields, P.R.; Moeller, T..
Advances in chemistry, Lanthanide/Actinide chemistry
. Advances in Chemistry.
71
. American Chemical Society. str. 1?12.
DOI
:
10.1021/ba-1967-0071
.
ISBN
0-8412-0072-6
.
- ↑
Day, M. C., Jr.; Selbin, J. (1969).
Theoretical inorganic chemistry
(2nd izd.). New York: Nostrand-Rienhold Book Corporation. str. 103.
ISBN
0-7637-7833-8
.
- ↑
Holman, J.; Hill, G. C. (2000).
Chemistry in context
(5th izd.). Walton-on-Thames: Nelson Thornes. str.
40
.
ISBN
0-17-448276-0
.
- ↑
15,0
15,1
Leigh, G. J. (1990).
Nomenclature of Inorganic Chemistry: Recommendations 1990
. Blackwell Science.
ISBN
0-632-02494-1
.
- ↑
Fluck, E. (1988).
?New Notations in the Periodic Table”
.
Pure and Applied Chemistry
(
IUPAC
)
60
(3): 431?436.
DOI
:
10.1351/pac198860030431
. Pristupljeno 24 March 2012
.
- ↑
17,0
17,1
Moore, p. 111
- ↑
18,0
18,1
18,2
Greenwood, p. 30
- ↑
Stoker, Stephen H. (2007).
General, organic, and biological chemistry
. New York: Houghton Mifflin. str. 68.
ISBN
978-0-618-73063-6
.
OCLC
52445586
.
- ↑
Mascetta, Joseph (2003).
Chemistry The Easy Way
(4th izd.). New York: Hauppauge. str.
50
.
ISBN
978-0-7641-1978-1
.
OCLC
52047235
.
- ↑
Kotz, John; Treichel, Paul; Townsend, John (2009).
Chemistry and Chemical Reactivity, Volume 2
(7th izd.). Belmont: Thomson Brooks/Cole. str. 324.
ISBN
978-0-495-38712-1
.
OCLC
220756597
.
- ↑
Gray, p. 12
- ↑
Jones, Chris (2002).
d- and f-block chemistry
. New York: J. Wiley & Sons. str.
2
.
ISBN
978-0-471-22476-1
.
OCLC
300468713
.
- ↑
Silberberg, M. S. (2006).
Chemistry: The molecular nature of matter and change
(4th izd.). New York: McGraw-Hill. str.
536
.
ISBN
0-07-111658-3
.
- ↑
Manson, S. S.; Halford, G. R. (2006).
Fatigue and durability of structural materials
. Materials Park, Ohio: ASM International. str. 376.
ISBN
0-87170-825-6
.
- ↑
Bullinger, Hans-Jorg (2009).
Technology guide: Principles, applications, trends
. Berlin: Springer-Verlag. str.
8
.
ISBN
978-3-540-88545-0
.
- ↑
Jones, B. W. (2010).
Pluto: Sentinel of the outer solar system
. Cambridge: Cambridge University Press. str.
169
?71.
ISBN
978-0-521-19436-5
.
- ↑
Hinrichs, G. D. (1869). ?On the classification and the atomic weights of the so-called chemical elements, with particular reference to Stas's determinations”.
Proceedings of the American Association for the Advancement of Science
18
(5): 112?124.
- ↑
29,0
29,1
Myers, R. (2003).
The basics of chemistry
. Westport, CT: Greenwood Publishing Group. str.
61
?67.
ISBN
0-313-31664-3
.
- ↑
30,0
30,1
Chang, Raymond (2002).
Chemistry
(7 izd.). New York: McGraw-Hill. str.
289
?310; 340?42.
ISBN
0-07-112072-6
.
- ↑
Greenwood, p. 27
- ↑
32,0
32,1
Jolly, W. L. (1991).
Modern Inorganic Chemistry
(2nd izd.). McGraw-Hill. str. 22.
ISBN
978-0-07-112651-9
.
- ↑
33,0
33,1
33,2
Greenwood, p. 28
- ↑
Međunarodna unija za ?istu i primenjenu hemiju
. "
Electronegativity
".
Kompendijum Hemijske Terminologije
Internet edition.
- ↑
Pauling, L.
(1932). ?The Nature of the Chemical Bond. IV. The Energy of Single Bonds and the Relative Electronegativity of Atoms”.
Journal of the American Chemical Society
54
(9): 3570?3582.
DOI
:
10.1021/ja01348a011
.
- ↑
Allred, A. L. (1960).
?Electronegativity values from thermochemical data”
.
Journal of Inorganic and Nuclear Chemistry
(Northwestern University)
17
(3?4): 215?221.
DOI
:
10.1016/0022-1902(61)80142-5
. Pristupljeno 11 June 2012
.
- ↑
Huheey, Keiter & Keiter, p. 42
- ↑
Siekierski, Slawomir; Burgess, John (2002).
Concise chemistry of the elements
. Chichester: Horwood Publishing. str. 35?36.
ISBN
1-898563-71-3
.
- ↑
39,0
39,1
Chang, pp. 307?309
- ↑
Huheey, Keiter & Keiter, pp. 42, 880?81
- ↑
Yoder, C. H.; Suydam, F. H.; Snavely, F. A. (1975).
Chemistry
(2nd izd.). Harcourt Brace Jovanovich. str.
58
.
ISBN
0-15-506465-7
.
- ↑
Huheey, Keiter & Keiter, pp. 880?85
- ↑
Sacks, O (2009).
Uncle Tungsten: Memories of a chemical boyhood
. New York: Alfred A. Knopf. str. 191, 194.
ISBN
0-375-70404-3
.
- ↑
Gray, p. 9
- Ball, Philip (2002).
The Ingredients: A Guided Tour of the Elements
. Oxford: Oxford University Press.
ISBN
0-19-284100-9
.
- Chang, Raymond (2002).
Chemistry
(7th izd.). New York: McGraw-Hill Higher Education.
ISBN
978-0-19-284100-1
.
- Gray, Theodore (2009).
The Elements: A Visual Exploration of Every Known Atom in the Universe
. New York: Black Dog & Leventhal Publishers.
ISBN
978-1-57912-814-2
.
- Greenwood, Norman N.; Earnshaw, A. (1984).
Chemistry of the Elements
. Oxford: Pergamon.
DOI
:
10.1002/crat.2170200510
.
ISBN
0-08-022057-6
.
- Huheey, JE; Keiter, EA; Keiter, RL (1993).
Principles of structure and reactivity
(4th izd.). New York: Harper Collins College Publishers.
ISBN
0-06-042995-X
.
- Moore, John (2003).
Chemistry For Dummies
. New York: Wiley Publications. str.
111
.
ISBN
978-0-7645-5430-8
.
OCLC
51168057
.
- Scerri, Eric (2007).
The periodic table: Its story and its significance
. Oxford: Oxford University Press.
ISBN
0-19-530573-6
.
- Scerri, Eric R. (2011).
The periodic table: A very short introduction
. Oxford: Oxford University Press.
ISBN
978-0-19-958249-5
.
- Venable, F P (1896).
The development of the periodic law
. Easton PA: Chemical Publishing Company.
- Ekkhard Fluck, Klaus G. Heumann:
Periodensystem der Elemente: physikalische Eigenschaften; [chemische, biologische und geologische Eigenschaften]
, 5. Auflage, Wiley-VCH, Weinheim 2012,
ISBN
978-3-527-33285-4
,
ISBN
3-527-33285-5
.
- Periodensystem interaktiv! (CD-ROM fur Windows und Mac OS X), Welsch & Partner, Tubingen K. Seubert, "Das naturliche System der Elemente von Lothar Meyer u. D. Mendelejew", Ostwalds Klassiker der exakten Wissenschaften" Bd. 68, 1895 (Nachdruck 1990)
- Ekkhard Fluck, Klaus G. Heumann:
Periodensystem der Elemente: physikalische Eigenschaften; [chemische, biologische und geologische Eigenschaften]
, 5. Auflage, Wiley-VCH, Weinheim 2012,
ISBN
978-3-527-33285-4
,
ISBN
3-527-33285-5
.
- Periodensystem interaktiv! (CD-ROM fur Windows und Mac OS X), Welsch & Partner, Tubingen K. Seubert, "Das naturliche System der Elemente von Lothar Meyer u. D. Mendelejew", Ostwalds Klassiker der exakten Wissenschaften" Bd. 68, 1895 (Nachdruck 1990)
- Agafo?in N. P.
Periodi?eskiй zakon i periodi?eskaя sistema эlementov D. I. Mendeleeva. ? M.: Prosveщenie, 1973. ? 208 s.
- Evdokimov Ю.
, kandidat himi?. nauk. K istorii periodi?eskogo zakona. Nauka i ?iznь, № 5 (2009), S. 12-15.
- Makarenя A. A., Rыsev Ю. V.
D. I. Mendeleev. ? M.: Prosveщenie, 1983. ? 128 s.
- Makarenя A. A., Trifonov D. N.
Periodi?eskiй zakon D. I. Mendeleeva. ? M.: Prosveщenie, 1969. ? 160 s.
- Nekrasov B.V. (1973).
Osnovы obщeй himii
.
1
. M.: Himiя. str. 656.
- Remi G. (1963).
Kurs neorgani?eskoй himii
.
1
. M.: Izd-vo inostrannoй lit-rы. str. 920.