Хиноны
? полностью сопряжённые циклогексадиеноны и их аннелированные аналоги. Существуют два класса хинонов: пара-хиноны с пара-расположением
карбонильных групп
(1,4-хиноны) и орто-хиноны с орто-расположением карбонильных групп (1,2-хиноны). Благодаря способности к обратимому восстановлению до двухатомных фенолов некоторые производные пара-хинонов участвуют в процессах биологического окисления в качестве
коферментов
ряда
оксидоредуктаз
.
Открытие хинонов было следствием исследований состава и свойств веществ, выделяемых из коры
хинного дерева
Cinchona
L., использовавшейся как антималярийное средство. Первый представитель хинонов был описан
А. А. Воскресенским
в его докторской работе ≪Рассуждение о хинной кислоте и открытом в ней новом теле хиноиле≫ (1839 г.), выполненной в лаборатории
Юстуса Либиха
[1]
под названием ≪хиноил≫ как продукт окисления
хинной кислоты
диоксидом марганца
в присутствии
серной кислоты
:

Берцелиус установил, что ≪хиноил≫ имеет свойства, схожие со свойствами
кетонов
и дал ему используемое поныне название хинон (от ≪хин-≫ ? хинная кислота и ≪-он≫ ? кетон). Работы Воскресенского по химии p-бензохинона были продолжены
Фридрихом Вёлером
, который в
1844
г. восстановлением p-бензохинона
сероводородом
получил
гидрохинон
[2]
: эта работа раскрыла фундаментальное отличие химии хинонов от химии ненасыщенных кетонов ? возможность обратимого восстановления хинонов. Одновременно Вёлером был открыт
хингидрон
?
молекулярный комплекс
p-бензохинона и гидрохинона, первый описанный в химической литературе молекулярный комплекс. Дальнейшие работы по химии хинонов были стимулированы развитием химии красителей и исследованиями
ализарина
? производного
антрахинона
.
В течение шести десятилетий после синтезов p-бензохинона и
гидрохинона
попытки получить o-бензохинон окислением пирокатехина оканчивались неудачей, до тех пор, пока
Вильштеттер
не предположил, что o-бензохинон чувствителен к влаге и не провёл его синтез окислением
оксидом серебра
в среде абсолютного эфира и в присутствии безводного
сульфата натрия
в качестве водопоглощающего агента:

Ядро хинонов не является
ароматическим
, вклад резонансных структур ароматического типа в свойства хинонов невелик. Спектроскопические свойства близки к свойствам 1,2-ненасыщенных кетонов, при этом свойства 1,4-хинонов ближе к перекрестно-сопряжённых ненасыщенным 1,4-дикетонов, в то время как 1,2-хиноны ближе к диендионам.
Так, например, простейший 1,4-хинон ? пара-бензохинон ? имеет жёлтую окраску, тогда как 1,2-бензохинон окрашен в ярко-красный цвет за счёт более длинной цепи сопряжения, обуславливающей
батохромный сдвиг
.
В инфракрасных спектрах для 1,4-хинонов типичны две полосы поглощения карбонила, обусловленные резонансом Ферми при 5.98 и 6.06 мкм, в случае 1,2-хинонов присутствует слабая полоса при 5.95 мкм и более сильная при 6.02 мкм. В спектрах
1
H
ЯМР
сигналы протонов хиноидного ядра лежат в области δ ~6.7, что близко к химическим сдвигам протонов при
двойной связи
α,β-ненасыщенных кетонов (δ 6.63 для α-протона метилвинилкетона
[3]
) и указывает на отсутствие эффекта кольцевого тока ароматической π-системы, то есть на неароматичность хиноидного ядра.
Хиноны ? кристаллические вещества с высокими температурами плавления, низшие хиноны окрашены, так как молекула имеет протяжённую цепь сопряжения.
Некоторые представители хинонов:
Общий метод синтеза хинонов ? как моноциклических бензохинонов и их производных, так и полициклических конденсированных хинонов, причём если для окисления производных бензола требуется, как правило, наличие электродонорных заместителей, активирующих ароматическое кольцо (например, гидрокси- или
аминогрупп
), то в случае
полициклических ароматических углеводородов
возможно и прямое окисление до соответствующих хинонов.
Окисление
активированных
ароматических соединений
может проводиться с использованием различных окислителей (CrO
3
/H
2
CrO
4
в кислой среде, Ag
2
O, Fe
3+
), однако для синтеза пара-бензохинонов наиболее широко используется
реакция Тойбера
? окисление активированных производных
бензола
(
фенолов
, ароматических аминов, аминофенолов)
солью Фреми
(нитрозодисульфонатом калия):

Соль Фреми
(KO
3
S)
2
NO
.
является стабильным нитроксильным
свободным радикалом
и окисление с её участием идёт по одноэлектронному механизму в мягких условиях: так, например, одноатомные фенолы и ароматические амины со свободным пара- положением в водном спирте или ацетоне в присутствии ацетатного или фосфатного
буфера
быстро окисляются двумя эквивалентами соли Фреми с выходами, близкими к количественным. Если пара-положение занято, реакция Тойбера ведёт к орто-хинону, однако может происходить и элиминирование p-заместителя (галогена или трет-бутильной группы)
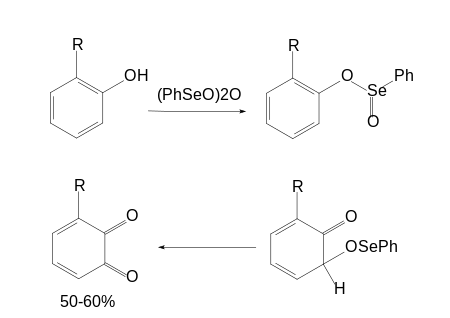
Синтез орто-хинонов из ароматических соединений со свободным пара-положением, являющийся проблемой при использовании большинства окисляющих агентов, может быть осуществлён исходя из одноатомных фенолов с использованием окислителя дифенилселенинового ангидрида: в этом случае за счёт промежуточной
этерификации
гидроксильной группы фенола происходит внутримолекулярное окисление в орто-положение образующегося интермедиата, пара-окисления при этом практически не происходит:
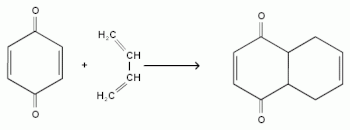
- Окисление конденсированных углеводородов:

Молекула хинона многоцентровая, поэтому для хинонов характерны реакции:
- по карбонильной группе (идут под действием сильных нуклеофильных реагентов): реакции нуклеофильного замещения и нуклеофильного присоединения.
- по сопряжённой системе связи: неароматический первичный продукт присоединения перегрупировывается в замещённый
гидрохинон
(1,4 ? гидроксибензол), в результате возникает термодинамически более выгодный ароматический продукт. Например, при реакции парабензохинина (1,4 ? бензохинон) с
HCl
образуется 1,4-гидрокси,3-хлорбензол.
- по двойной связи(с образованием циклопродуктов):
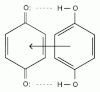
- восстановление сопровождается переносом одного электрона. Присоединение одного электрона приводит к образованию
семихинона
(
анион-радикала
), после присоединения второго электрона образуется дианион двухатомного фенола, конечный продукт восстановления ?
гидрохинон
:

В процессе восстановления хинонов образуется окрашенный в темно-зелёный цвет промежуточный комплекс с переносом заряда ?
хингидрон
, в котором образуется
водородная
и
донорно-акцепторная связь
:
Восстановление хинонов до двухатомных фенолов проводят с помощью самых разнообразных восстановителей, среди которых в лабораторных условиях предпочтение отдаётся дитиониту натрия Na
2
S
2
O
4
в щелочной среде.
[4]
Хиноны являются структурной основой пигментов. Важнейший краситель ?
ализарин
(1,2-диоксиантрахинон). Ализариновые красители светоустойчивы, применяются в лакокрасочной промышленности,
полиграфии
. Но из-за большой стоимости используются реже, чем
азокрасители
.
Окислительные свойства хинонов проявляются в биохимических реакциях.
Убихиноны
(
коферменты Q
) распространены в животном и растительном мире, участвуют в переносе электронов и протонов в
дыхательной цепи
.
- ↑
И. С. Дмитриев
. Взгляд на формирование химических школ Петербурга. Природа, № 9, 2003
(неопр.)
. Дата обращения: 18 мая 2014.
Архивировано
5 марта 2016 года.
- ↑
Wohler, F. Untersuchungen uber des Chinons. Ann. 1844, 51, 152
- ↑
Х. Гюнтер
. Введение в курс спектроскопии ЯМР, М., 1984 (стр. 92)
- ↑
[1]
Архивная копия
от 23 мая 2012 на
Wayback Machine
"Органическая химия.В 4-х частях.Ч.3/О.А.Реутов, А.Л.Курц, К.П.Бутин - М, БИНОМ.Лаборатория знаний, 2004. - 544 с., ил."
- Л. Физер, М. Физер
. Органическая химия. Углублённый курс. М.: Химия, 1996. т.2, гл. 26 Хиноны и ареноны.
- Е. В. Федоренко, И. В. Богомолова
≪Органическая химия≫,
ISBN 978-5-369-00143-1
 Ссылки на внешние ресурсы
|
|---|
| |
|---|
В библиографических каталогах
|
|---|
|
|