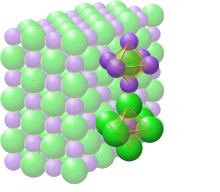
 A imagem mostra um exemplo de reticulo cristalino, o NaCl, de um composto ionico. As esferas verdes se referem ao cloreto e as azuis ao ion de sodio. Na imagem, tambem, sao destacados os arranjos de coordenacao de cada ion.
A imagem mostra um exemplo de reticulo cristalino, o NaCl, de um composto ionico. As esferas verdes se referem ao cloreto e as azuis ao ion de sodio. Na imagem, tambem, sao destacados os arranjos de coordenacao de cada ion.
Ligacao
ionica
(
portugues brasileiro
)
ou
ionica
(
portugues europeu
)
e um tipo de
ligacao quimica
baseada na
atracao eletrostatica
[
1
]
de
ions
com cargas opostas. O exemplo mais comum de composto ionico e o cloreto de sodio (NaCl), que e o principal constituinte do sal de cozinha
[
2
]
.
A representacao dos compostos ionicos e feita por meio de formulas minimas ou unitarias, ou seja, a representacao NaCl, nao se refere a simplesmente uma ligacao entre um atomo de sodio e um atomo de cloro, pelo contrario, ela representa uma estrutura minima que se repete em todo o reticulo cristalino do composto, onde os ions de sodio (Na
+
) estao em proporcao de 1 para 1 com os ions cloreto (Cl
-
)
[
3
]
.
A maioria dos compostos ionicos tem origem mineral, podendo ser encontrados no solo ou dissolvidos em agua
[
4
]
.
Na agua do mar, por exemplo, existem ions dissolvidos
[
2
]
. Alguns desses ions sao positivos, como sodio, potassio e calcio, e outros sao negativos, como cloreto, bicarbonato e sulfato. Ao evaporarmos a agua do mar por aquecimento, a remocao das moleculas de agua faz com que se intensifique a interacao atrativa entre os ions positivos e negativos, favorecendo o agrupamento desses ions em reticulos cristalinos, ate que se formem os cristais de compostos ionicos solidos
[
5
]
. E assim que se obtem o sal (cloreto de sodio) a partir da agua do mar nas salinas.
A ligacao ionica ocorre entre elementos metalicos e nao-metalicos, ou entre metais e o hidrogenio
[
3
]
. Essa ligacao e formada quando ha um conglomerado de atomos na forma de ions e a energia que os mantem justos e menor que a energia que os mantem separados. Com isso, as especies sao mantidas juntas por meio de forcas eletrostaticas
[
4
]
.
Para obter as especies ionicas, ha processos que podem ser feitos. Um exemplo seria obter o Oxido de Magnesio (MgO), um composto ionico, a partir da combustao do magnesio metalico
[
3
]
. A reacao e a seguinte:
 [
3
]
[
3
]
Nesse caso, ha formacao de um produto ionico, uma vez que a energia de ligacao e menor que a energia de formacao das especies e a energia que os mantem separados, e a juncao desses pelas forcas eletrostaticas fornecem estabilidade as especies
[
3
]
.
 Celula unitaria do arranjo cristalino do Cloreto de Sodio. Na
+
esferas azuis; Cl
-
esferas verdes.
Celula unitaria do arranjo cristalino do Cloreto de Sodio. Na
+
esferas azuis; Cl
-
esferas verdes.
 Imagem de dois ions, por exemplo Na
+
e Cl
-
formando uma ligacao ionica. Os
orbitais eletronicos
geralmente nao se sobrepoem (i.e.,
orbitais moleculares
nao sao formados), devido ao fato de que cada ion chega ao
estado energetico
mais baixo e a ligacao e baseada somente (teoricamente) em interacoes eletrostaticas entre os ions positivo e negativo.
Imagem de dois ions, por exemplo Na
+
e Cl
-
formando uma ligacao ionica. Os
orbitais eletronicos
geralmente nao se sobrepoem (i.e.,
orbitais moleculares
nao sao formados), devido ao fato de que cada ion chega ao
estado energetico
mais baixo e a ligacao e baseada somente (teoricamente) em interacoes eletrostaticas entre os ions positivo e negativo.
Os
ions
em
cristais
de compostos predominantemente ionicos sao
esfericos
, mas, se o ion positivo e pequeno e/ou altamente carregado, sera distorcida a nuvem eletronica do ion negativo. Essa
polarizacao
do ion negativo leva a criacao de uma densidade de carga extra entre os dois nucleos atomicos, i.e., a covalencia parcial. Ions negativos grandes sao mais facilmente polarizados, mas, normalmente, o efeito so tem relevancia quando ions positivos com cargas de 3+ (ex., Al
3+
) estao envolvidos (ex., AlCl
3
puro e uma molecula covalente). No entanto, ions com carga 2+ (Be
2+
) ou ate com carga 1+ (Li
+
) demonstram algum grau de polarizacao devido ao seu pequeno
raio atomico
(ex., LiI e ionico, mas tem algum carater covalente). O
Grau de Polarizacao
depende da relacao de carga e do tamanho do ion, geralmente chamada de
densidade de carga
.
Compostos ionicos
no estado solido formam uma estrutura ionica continua em um
cristal ionico
. A forma mais simples de cristal ionico e um
cubico simples
. Nessa forma todos os atomos estao posicionados nas extremidades de um cubo. Essa
celula unitaria
tem a massa que e a mesma de 1 dos atomos envolvidos. Quando todos os ions tem aproximadamente o mesmo tamanho, eles podem formar uma estrutura igual chamada
cubica de face-centrada
(onde a massa e 4 vezes massa atomica), mas, quando os ions tem tamanhos diferentes, a estrutura e geralmente
cubica de corpo-centrado
(2 vezes a massa). Em reticulos ionicos o
numero de coordenacao
se refere ao numero de ions que cada reticulo esta ligado.
A estrutura do cristal ionico e dependente das energias de coesao existentes no cristal, que, por sua vez, sao as energias de atracao e repulsao que existem entre os atomos que fazem parte do cristal ionico. Conforme ja descrito, as interacoes sao coulombicas, ou seja, eletroestaticas e a energia pode ser calculada pela seguinte relacao:

Onde k = 4π?
0,
com ?
0
sendo a constante de permissividade do vacuo, Z
+
e Z
_
referem-se as cargas dos compostos e r representa a distancia entre as cargas. Ainda assim, uma outra formula pode relacionar melhor o fenomeno, considerando todas as interacoes existentes entre todos os atomos e considerar o fator geometrico do solido, atraves da constante de Madelung (A, A = 0,69315) e a constante de Born-Lande (B), que relaciona as forcas de repulsao existentes quando ha a superposicao de distribuicoes eletronicas, inclusive:

Em que n e o expoente de Born. O segundo membro dessa soma representa a forca de repulsao existente no cristal ionico.
[
6
]
Estudos revelaram que nao existe ligacao ionica
pura
[
3
]
. Todas ligacoes ionicas tem um grau de
ligacao covalente
ou
ligacao metalica
. Quanto maior a diferenca na
eletronegatividade
entre dois atomos mais ionica se torna a ligacao
[
3
]
. Compostos ionicos conduzem
eletricidade
quando fundidos ou em solucao. Eles geralmente tem um alto
ponto de fusao
e tendem a ser soluveis em agua
[
4
]
.
Em uma ligacao ionica, os atomos estao ligados pela atracao de ions com cargas opostas, enquanto que em uma
ligacao covalente
, os atomos estao ligados por compartilhamento de eletrons. Na ligacao covalente, a
geometria molecular
de cada atomo e determinada pelas regras da
VSEPR
(Valence Shell Electron Pair Repulsion Theory - Teoria da repulsao entre os pares de eletrons da camada de valencia), enquanto que, em materiais ionicos, a geometria segue as regras do empacotamento maximo e a resultante das cargas desses ions no empacotamento tende a ser nula.
Ha, no entanto, uma tenue linha divisoria entre a ligacao
covalente
e a ionica. O carater ionico de uma ligacao pode ser definido por:
![{\displaystyle (\%)=100\times [1-\exp {[(-0,25-\Delta E^{2})]{}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a079afaa0404d6999a94c5f7c6775943c6471246)
Onde
 e a diferenca de eletronegatividade dos atomos.
Linus Pauling
estabeleceu que se essa diferenca for superior a 1,7eV a ligacao e considerada ionica. No entanto, pode-se dizer que a ligacao Carbono-Bromo (
e a diferenca de eletronegatividade dos atomos.
Linus Pauling
estabeleceu que se essa diferenca for superior a 1,7eV a ligacao e considerada ionica. No entanto, pode-se dizer que a ligacao Carbono-Bromo (
 < 1,65) tem carater levemente ionico.
[
7
]
< 1,65) tem carater levemente ionico.
[
7
]
De uma maneira mais precisa e mais visualizavel, o Triangulo de Ketelaar e uma proposta de entendimento eficaz do carater ionico, covalente e/ou metalico, do composto a ser analisado. Essa especie de diagrama leva em consideracao a eletronegatividade de Pauling (dado expresso na tabela periodica) e a diferenca de eletronegatividade entre os atomos participantes da interacao. Com isso, o carater ionico de certos compostos pode ser observado de maneira mais precisa e, alem disso, o carater covalente dos compostos considerados ionicos pode ser verificado tambem. Nao apenas esses, mas o carater metalico tambem pode ser verificado nesse diagrama. Compostos como o HF (fluoreto de hidrogenio) e considerado um composto covalente, porem, quando observado sob a otica do Triangulo de Ketelaar, demonstra um acentuado carater ionico. As tres caracteristicas (ionica, metalica e covalente) sao representadas em cada um dos vertices do triangulo e, quanto mais houver proximidade dos vertices, maior proximidade do carater designado por este.
Referencias
- ↑
Atkins, Peter (2001).
Principios de Quimica:Questionando a vida moderna e o meio ambiente
. Porto Alegre: Bookman. 181 paginas
- ↑
a
b
Pereira, Airton Vicente; Belinski, Andriele Costa; Valus, Natalicio; Beltrame, Flavio Luis (27 de outubro de 2008).
≪Avaliacao da Qualidade de Amostras Comerciais de Sal de Cozinha≫
.
Iniciacao Cientifica Cesumar
(2): 97?101.
ISSN
2176-9192
. Consultado em 18 de julho de 2022
- ↑
a
b
c
d
e
f
g
Atkins, P. W. (2012).
Principios de quimica : questionando a vida moderna e o meio ambiente
. Loretta Jones 5. ed ed. Porto Alegre: Bookman.
OCLC
940011380
- ↑
a
b
c
D., Lee, J. (1999).
Quimica inorganica nao tao concisa
. [S.l.]: Edgard Blucher.
OCLC
46759356
- ↑
ROCHA, Pedro Filipe Coelho.
Dessalinizacao de agua do mar
. 2014. 88 f. Dissertacao (Mestrado) - Curso de Engenharia Eletronica Industrial e Computadores, Escola de Engenharia, Universidade do Minho, [S.L], 2014.
- ↑
DUARTE, Helio.
≪Ligacoes Quimicas: Ligacao Ionica, Covalente e Metalica≫
(PDF)
.
Quimica Nova na Escola
. Consultado em 20 de abril de 2015
- ↑
≪A quimica antes da quimica do solo≫
(PDF)
. Consultado em 17 de fevereiro de 2021