 Pilas salinas e alcalinas, mai correntas.
Pilas salinas e alcalinas, mai correntas.
Una
pila electrica
, o
pila
, es un dispositiu
electroquimic
que convertis l'
energia quimica
en energia electrica merce a una
reaccion quimica
d'
oxidoreduccion
.
A l'origina, lo terme ≪ pila ≫ designa un dispositiu inventat pel sabent italian
Alessandro Volta
, compausat d'un em
pila
ment de rondelas de dos metals diferents, separats per de feutres banhat d'un
electrolit
. Per extension, lo mot ≪ pila ≫ designa una bataria monobloc. Pasmens, lo terme ≪ bataria ≫ designa un ensemble d'elements montats en seria per obtener una tension volguda
[1]
, dins un emballatge unic. Dins aqueste sens es abusiu lo terme ≪ pila ≫ per designar d'autres generators electroquimics
:
pila de combustible
,
acumulator electric
.
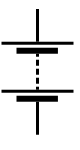 Simbol electronic d'una pila que se referis a l'estructura de la
pila voltaica
.
Simbol electronic d'una pila que se referis a l'estructura de la
pila voltaica
.
 Esquema d'una pila. Cada aisina constituis una mijacellula. Un electrode (simbolizat per una brica) es perlongada dins cada miejacellula. Las doas miejacellulas son ligadas per un
pont salin
que servis al manten de l'equilibri de las cargas electricas. Aqueste pont permet lo passatge d'
ions
, mas pas aqueste del solvent. Quand los electrodes son constituits de materials presentant una diferencia de potencial sufisenta, un corrent electric s'establis del
catode
e de l'
anode
, es a dire de l'electrode positiu a l'electrode negatiu.
Esquema d'una pila. Cada aisina constituis una mijacellula. Un electrode (simbolizat per una brica) es perlongada dins cada miejacellula. Las doas miejacellulas son ligadas per un
pont salin
que servis al manten de l'equilibri de las cargas electricas. Aqueste pont permet lo passatge d'
ions
, mas pas aqueste del solvent. Quand los electrodes son constituits de materials presentant una diferencia de potencial sufisenta, un corrent electric s'establis del
catode
e de l'
anode
, es a dire de l'electrode positiu a l'electrode negatiu.
La bostia d'una pila abriga una reaccion quimica entre doas substencias que l’una pot donar aisidament d'electrons (materials reductor), e l’autre que los pen (material oxidant). Caduna d'aquesta reaccions quimicas est dicha ≪ miejaaccion ≫. Quant son netament combinadas, forman una reaccion d'oxidoreduccion. Cada miejareaccion se passa dins una solucion ont se realiza un escambi d'electrons. Son aquestes electrons que son escambiats entre las doas substencias. Per assegurar l'equilibri dels escambis electrics, cal ligar las doas solucions mejans un
pont salin
, sistema que permet lo transport d'unes ions tot interdisent la circulacion del
solvent
.
Cada element del coble oxidant/reductor es ligat a un
electrode
. Aquestes electrodes, quand son ligadas a un consomator electric, venent de la circulacion d'un
corrent electric
; la reaccion quimica provoca una circulacion de cargas (
electrons
,
ions
). Una pila dona donc de
corrent continu
. La borna (-) d'una pila correspond a l'anode ont se realiza la reaccion d'oxydacion que donara los electrons. La borna (+) d'una pila correspond al catode ont se realiza la reaccion de reduccion que recebrera los electrons.
Aqueste sistema es utilizat per las pilas electricas e las batarias d'acumulators, amb diferents cobles electroquimics. Una pila electrica pot contener mai d'un d'aquestes cobles montats en seria, co que permet d'aumentar la tension disponibla a las bornas de la pila.
Es possible de realizar una pila artesanala, per exemple en fissant dins un citron un estaca desplegada o un
clavel
(en
acier
galvanizat, cobert donc de
zinc
) e un fil electric desnudat (de
coire
) ligats una pichona lampa o un
diode electroluminescent
plan causit
[2]
.
Exitis d'objectes arqueologics, coma aquestes trobats en 1936, pareissent a de pilas. Es lo cas de la
pila electrica de Bagdad
qu'es datada entre
250 AbC
e
250
mas poirian esser plan mai anciana e explicarian lo placatge tan perfiech de forca joias anticas tan leugieras. Aurian foncionat amb de chucs de fruchs veire de
sulfat de coire
, d'experimentacions sus de reconstitucions modernas valideron la fasabilitat de dos models. Existis pas cap de ligam istoric entre aquestes objectes e lo desvelopament de las pilas contemporaneas tan que l'usatge d'aquestas serian lo placatge de metals precioses co qu'explicarian son usatge minor, confidencial, veire associat a un usatge de falssari (veire
Arquimedes e la corona del rei Ieron
)
[3]
,
[4]
.
En 1786,
Luigi Galvani
observa que los muscles d'una cueissa de granhota se contractan quand son placadas en contacte amb de metals, del mesme biais que quand se connecta la branca sus una maquina electrostatica. Descobris que la reaccion es mai forta quand utiliza un instrument compausat de dos metals diferents.
En oposicion amb la recercas de Galvani (electricitat d'origina animala),
Alessandro Volta
inventa la premiera
pila en colomna
lo 17 de marc de 1800
[5]
; aquestes primiers sistemas eran constituits d'un ≪ em
pila
ment ≫ de disques de dos metals diferents separats per de disques de feutre, banhats d'
acid
, d'ont lo nom de l'invencion. La pression de la colomna suls disques del bas provoca un assecament dels cilindres de feutre que s'acaba lo proces. Volta inventa leu la pila en corona, constituida d'empilaments mai pichon montas en seria.
Unes meses apres l'invencion de Volta, dos quimistas britanics,
William Nicholson
(1753-1815) e
Anthony Carlisle
(1768-1840) utilizan la pila de Volta per realizar la primiera electrolisi artificiana (
electrolisi de l'aiga
) lo 2 de mai de 1800.
En 1802,
William Cruickshank
crea la
pila de nauc
pausant verticalament las lamas de zinc e de coire dins un nauc de parets isolantas emplit d'aiga acidulada. Es forca mai simpla de realizar que la pila de Volta.
- Diferents tipes de pila Volta
-
La pila voltaica, inventada per Alessandro Volta
-
Autra pila de colomna de Volta, comencament del segle XIX
-
Esquema de foncionament de la pila Volta
-
Esquema de la pila Volta
Entre 1813 e 1815,
William Hyde Wollaston
desvelopa la
pila Wollaston
ont l'electrode de coire enroda l'electrode de zinc. Aquo permet de doblar la superficia de l'electrode e de perlongar lo foncionament de la pila. Aquestas primieras pilas an una deca de foncionament
: la
polarizacion dielectrica
.
La reaccion d'oxydoreduccion provoca una accumulacion de sosproduchs que perturba lo foncionament de la pila. Dins aquestas pilas zinc-coire es la reduccion de l'acid de l'electrolit que larga de bofigas de diidrogen sul coire qu'empacha lo passatge del corrent. Amb lo temps, se cal netejar la pila d'aquestes depauses per que contunha de foncionar.
 Esquema del principi de la pila Daniell.
Esquema del principi de la pila Daniell.
Dins las pilas impolarisablas, los produchs de la reaccion d'oxidoreduccion utilizada altran pas las proprietats electroquimicas de l'ensemble.
En 1829,
Antoine Becquerel
crea la primiera pila de dos liquids separats embarrant la placa de zinc en solucion acid dins un gros budel de buou, que la separa de l'electrode de coire placat dins un banh de sulfat de coire. La generacion d'idrogen es remplacada per una accumulacion de coire suls parets del catode.
Lo principi es melhorat en 1836 per
John Frederic Daniell
que remplaca lo bubel per un vas de terra porosa. La
pila Daniell
es la primiera a esser una font duradissa d'energia. Lo principi de la pila Daniell sera meliorat coma amb las
pilas Callaud
.
Johann Christian Poggendorff
inventa en
1842
la
pila de bicromat
: larga d'oxigen que se torna combinar amb l’idrogen responsable de la polarizacion. Creada en
1850
, la
pila Grenet
es una pila d'un sol liquid, amb d'electrodes en carbon e en zinc amalgamat (perlongat dins lo mercuri) dins un electrolit d'acid sulfuric e de
bicromat de potassi
. Quand la pila era pas utilizada, se cal levar l'electrode en zinc de la solucion per la gardar. De melhoracions (pila Trouve, pila Chardin, pila Voisin e Dronier…) segueron per isolar aquesta electrode.
Aquestas pilas botelhas seran utilizadas fins al comencament del segle XX
: la potencia e la tension nauta de las pilas de bicromat fogueron longtemps apreciadas al laboratoris. Fogueron paud utilizadas coma pila domestica a causa de la toxicitat dels bicromats e dels problemas d'entreten de l'electrode.
 Pilas botons.
Pilas botons.
 Pila Bunsen.
Pila Bunsen.
Las pilasa de depolarizacion utilizan un reductor per levar los produchs de reaccion que se forman sul catode.
La primiera pila de depolarizacion es inventada en 1838 per
William Robert Grove
. Remplaca lo coire per de platin e utiliza d'acid nitric (nomenat acid azotic a l'epoca). Obten una pila poderosa mas cara que lo platin es un metal rar. En 1843,
Robert Wilhelm Bunsen
remplaca lo platin per de carbon co que redusis plan los costs (veire
Pile Bunsen
) mas la depolarizacion nitrica provoca un largatge de vapors toxicas que fa l'empec d'aquestas pilas malcomode.
En
1867
,
Georges Leclanche
crea la primiera pila de depolarizant solid
: conten de
dioxid de manganes
. La
pila Leclanche
es mens poderosa que la pila botelha mas demanda pas entreten (≪ ne s'usa que se'n servis ≫ segon la publicitat de la pila
Wonder
). En
1888
,
Carl Gassner
inventa la pila seca gelificant la solucion de clorur d'amoni amb d'
agar-agar
. Amb de melhoracions, aquesta pila seca es encara utilizada al segle XXI.
Pendent la
Segonda Guerra mondiala
,
Samuel Ruben
e
Philip Mallory
crean la
pila de mercuri
.
En
1959
, la primiera
pila alcalina
grand public es concebuda per
Lewis Urry
,
Karl Kordesch
e
P.A Marsal
pr
Union Carbide
.
En 1970, las primieras pilas de liti, que permeton de remplacar lo zinc per un metal mai reductor, son realizadas. Son comercializadas en 1977.
De pilas an estat utilizadas coma referencia per definir una norma de tension abans d'esser remplacada per una mesura basada sus l'
efiech Josephson
: la pile Daniell, puei la cellula de Clark inventada en 1872 per Josiah Latimer Clark foguet utilizada fins a 1905, puei remplacada per la cellula de Weston fins a 1972.
Tanben existisson de pilas de concentracion que son de dispositius electroquimics coma las pilas (doas solucions e un pont salin) que prenon lor energia de la diferencia de concentracion d'un solutat d'una solucion cap a l'autra. Las solucions e los anodes son totas de mesme tipe. Es un metode simple per realizar l'electricitat. Aqueste model de pila s'utiliza subretot dins l'industria metallurgica per realiza la
galvanizacion
e de l'estudi de la
corrosion
.
 Diferents ties de pilas
Diferents ties de pilas
Existis quatre tecnologias de pilas grand public
:
- pila alcalina
: ( ? Zn | Zn(OH)
4
2?
| K
+
+ OH
?
| MnO(OH) | MnO
2
| C ? );
- pila salina
: ( ? Zn | Zn
2+
| NH
4
+
+ Cl
?
| MnO(OH) | MnO
2
| C ? );
- pila de liti
: ( ? Li
(s)
| LiCl
(SOCl
2
)
| MnO
2 (s)
, Mn
2
O
3 (s)
| Fe
(s)
? );
- I a tanben de pilas d'oxid d'argent (de pilas botons per relotge) o de pilas zinc-aire (utilizadas per exemple disn las protesis auditivas) (? Zn | ZnO || Ag
2
O | Ag | C ?).
Dempuei decembre de 1998, las pilas de mercur son interditas en
Europa
(directiva 98/101/CE) e als
EUA
a causa de la toxicitat e de l'impacte environamental del
mercuri
.
Los formats de pilas son sovent designadas per un codi (AA, LR12, CR2032…) normalizat per la Comission electrotecnica internacionala (CEI) e per l'American National Standards Institute (ANSI). Pasmens se la norma CEI veguet un estandard, nombre d'apellacions son aquestas dels fabricants de pilas demoran.
La forca electromotritz (f.e.m.) es la tension qu'existis a la bornas de la pila en circuit dubert. La f.e.m es variabla amb lo temps e es foncion de la capacitat restanta de la pila
: diminuis amb la descarga de la pila.
La f.e.m nominala es la f.e.m de la pila e l'estat nou, e es aquesta qu'es inscricha sus la quita pila o son emballatge
Las pilas salinas e alcalinas an una f.e.m. gaireben nominala de 1,5 V, alara qu'aquestas de las pilas de lithi es de 3,6 V gaireben.
Las pilas amb f.e.m. mai nautas son constituidas d'una associacion en seria de cellulas de 1,5 V (3 elements en seria, dins una pila 3LR12 de 4,5 V; 6 dins una pila 6LF22 de 9V).
La capacitat d'una pila es la quantitat maximala de
carga electrica
que dona pendent sa descarga.
Dins lo
SI
, s'exprimis en
coulomb
, mas s'utiliza mai sovent l'amper ora (1 A?h = 3 600 C) o lo miliamper ora (1 mA?h = 3,6 C).
Depend de la quantitat d'electrolit e d'electrode, mas tanben de las condicions de descarga (intensitat del corrent de descarga, tension de copadura de l'aparelh, temperatura d'utilizacion)
[6]
.
Se l'intensitat de descarga
I
es constanta, la capacitat
Q
es proporcionala a la duretat de descarga Δ
t
:

Se l'intensitat
i
varia, alara:

La capacitat teorica d'una pila, definida pels fabricants, es de 20 oras (lo temps de descarga) multiplicat pel corrent que pot donar la pila pendant aquesta durada. Es observada a 20 °C sus un equipament normalizat. Sa mencion es pas obligatoria alara es rarament mencionada.
 Un aparelh oer verificar la tension d'una pila.
Un aparelh oer verificar la tension d'una pila.
La relacion entre lo corrent, la descarga e la capacitat per una bataria au plomb es aproximativament determinada per la
lei de Peukert
modelizant la capacitat d'una pila en foncion del corrent debitat.

ont
:
 es la capacitat de descarga a 1
amper
(A);
es la capacitat de descarga a 1
amper
(A);
 es lo corrent debitat per la bataria en ampers;
es lo corrent debitat per la bataria en ampers;
 es lo temps que la bataria poira tener;
es lo temps que la bataria poira tener;
 es una constanta empirica de l'ordre de 1,3;
es una constanta empirica de l'ordre de 1,3;
Per las bassas potencias, l'auto-descarga deu esser integrada.
En practica, una bataria es mai eficaca s'es descargada amb una bassa intensitat. Per una pila qu'a una autodescarga relativament nauta, l'autodescarga pot consomar la majoritat de la capacitat de la bataria. De precisar que totas las pilas se descargan amb lo temps, quitament se son pas utilizadas. Existis de tecnologias de pilas activablas que permeton de retardar l'aviada de la reaccion. Son per exemple utilizadas dins los elements de seguretat (coissin gonflable, balisa de destressa de nau, etc.) o dins unas aplicacions militaras. Es tanben lo cas de las pilas botons zinc-aire, cal levar la langueta que capa l'element abans de lo metre en servici.
En corrent continu, l'energia es lo multiple de l'intensitat e del temps per la tension. S'obten donc
:
- 1
W?h
↔ (1
A·h
× 1
V
) ↔ (1
A
× 1
h
× 1 V)
Cal pas confondre la capacitat d'una pila (exprimit en Amper.ora) e la potencia que pot donar (exprimit en Volt.Amper).
Forca pilas son utilizadas per grop de 2 a 6 elements en seria. La performancia d'un assemblatge de pilas connectada en seria es aquesta de son element mai feble.