- ?is raksts ir par atoma orbit?li. Par cit?m j?dziena
orbit?le
noz?m?m skat?t
noz?mju atdal??anas lapu
.
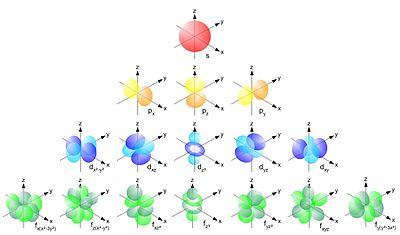 Da??di atomu orbit??u veidi (
s
,
p
,
d
un
f
orbit?les)
Da??di atomu orbit??u veidi (
s
,
p
,
d
un
f
orbit?les)
Orbit?le
jeb, prec?z?k,
atom?r? orbit?le
, vienk?r?ot? skaidrojum? ir t? telpas da?a ap
atoma kodolu
, kur
elektrona
atra?an?s vieta ir visvarb?t?g?k?.
[1]
Matem?tiski orbit?le ir uzskat?ma par elektrona
vi??u funkciju
, kuras j?ga izriet no
?r?dingera vi??u vien?dojuma
. Elektroni neri??o ap atoma kodolu pa t?d?m
orb?t?m
, k?
plan?tas
ap
Sauli
, kaut ar? novecoju?o
Bora atoma uzb?ves modeli
joproj?m m?dz izmantot m?kslinieciskos z?m?jumos. Elektroniem saska?? ar
kvantu meh?nikas
priek?statiem piem?t ne tikai da?i?u, bet ar? vi??u ?pa??bas. To kust?bu atom? apraksta, izmantojot vi??u funkciju, kam da??d?s atoma viet?s ir da??da v?rt?ba. Vi??u funkcijas kvadr?ts raksturo elektrona atra?an?s
varb?t?bu
noteikt? telpas punkt?, un past?v priek?stats par "
elektrona m?koni
", kura bl?vums da??dos punktos ir proporcion?ls elektrona atra?an?s varb?t?bai ?ajos punktos. Da?reiz terminu 'elektrona m?konis' lieto k? sinon?mu terminam 'orbit?le'.
[2]
Tom?r orbit??u forma (iz?emot vienk?r??k?s ?
s
tipa orbit?les) nedaudz at??iras no elektronu m?ko?u formas, jo orbit?li apraksta vi??u funkcija, bet elektrona m?koni ? t?s kvadr?ts.
[3]
Lai viennoz?m?gi aprakst?tu atom?r?s orbit?les, izmanto t? saucamos
kvantu skait?us
. Orbit?les ener?ijas l?meni pamat? nosaka galvenais kvantu skaitlis, bet t?s formu (ener?ijas apak?l?meni) ? orbit?lais kvantu skaitlis. Pirmaj? ener?ijas l?men? var b?t tikai viena veida orbit?les ?
s
orbit?les, kam ir
sf?riska
forma. Otraj? l?men? ir divu veidu jeb apak?l?me?u orbit?les ? lodveida
s
orbit?les un hanteles veida
p
orbit?les. Tre?aj? ener?ijas l?men? bez
s
un
p
orbit?l?m iesp?jamas v?l ar? "?etrlapi?u"
d
orbit?les, bet ceturtaj? ? papildus trim iepriek??j?m v?l ar?
f
orbit?les, kam ir v?l sare???t?ka forma. Piektaj? l?men? teor?tiski iesp?jamas v?l ar? pavisam sare???ta veida
g
orbit?les, tom?r l?dz ?im ieg?to ??misko elementu atomos ??s orbit?les netiek aizpild?tas, taj?s elektroni atrodas tikai ierosin?tos atomos.
Orbit??u novietojumu telp? apraksta tre?ais kvantu skaitlis ? magn?tiskais kvantu skaitlis. T? k? sf?risk?s
s
veida orbit?les ir piln?gi simetriskas, t?m ir tikai viens magn?tiskais kvantu skaitlis. N?kam? veida ?
p
orbit?l?m ? ir iesp?jami tr?s magn?tiskie kvantu skait?i, kas atbilst "hanteles" novietojumam pa X, Y vai Z asi
Dekarta koordin?tu sist?m?
.
d
orbit?l?m atbilst jau 5 magn?tiskie kvantu skait?i, t?d?? iesp?jami pieci
d
orbit??u novietojumi ? ?etros veidos telp? novietota ?etrlapi?u fig?ra un v?l viens sare???t?ks veids ? hantele ar gredzenu. Katram n?kamajam orbit?les tipam magn?tiskais kvantu skaitlis pieaug par 2. Iesp?jami 7
f
orbit??u novietojumi vai 9
g
orbit??u novietojumi. L?dz ar to pirmaj? ener?ijas l?men? kop? iesp?jama tikai viena orbit?le, otraj? ? ?etras (viena
s
un tr?s
p
orbit?les), tre?aj? ? 9 (1
s
, 3
p
, 5
d
orbit?les), t.i., iesp?jamo orbit??u skaits dotaj? ener?ijas l?men? vien?ds ar l?me?a numura kvadr?tu.
Past?v v?l ar? ceturtais kvantu skaitlis ? spina kvantu skaitlis. Katrai orbit?lei atbilst divi spina kvantu skait?i.
Spinu
vienk?r?oti var izt?loties k? elektrona grie?anos ap savu asi, bet rot?cija iesp?jama divos virzienos. T?d?? vien? orbit?l? saska?? ar
Pauli principu
var atrasties divi elektroni. Pauli princips nosaka, ka atom? nevar b?t divi elektroni, kam vien?di visi ?etri kvantu skait?i. T?d?j?di katr? atoma ener?ijas l?men? iesp?jamais maksim?lais elektronu skaits vien?ds ar divk?r?otu ener?ijas l?me?a numura jeb galven? kvantu skait?a kvadr?tu. Atoma orbit??u kopumu ar vien?du galveno kvantu skaitli sauc par
elektronu ?aulu
. Elektronus, kas atrodas ?r?j? elektronu ?aul?, sauc par
v?rt?bas elektroniem
jeb valences elektroniem.
Neierosin?tu atomu orbit?les aizpild?s ar elektroniem t?, lai elektroni atrastos viszem?kajos iesp?jamos ener??tiskajos st?vok?os. Orbit??u ener?ija pieaug ??d? sec?b? (cipars noz?m? galveno kvantu skaitli jeb elektronu ?aulas numuru):
- 1
s
< 2
s
< 2
p
< 3
s
< 3
p
< 4
s
?3
d
< 4
p
< 5
s
?4
d
< 5
p
< 6
s
?5
d
?4
f
< 6
p
utt.
Elektronu ?aulas aizpild??anos (galvenais kvantu skaitlis vien?ds) nosaka
K?e?kovska likums
, bet ener?ijas apak?l?me?u (galvenais un orbit?lais kvantu skaitlis vien?di) aizpild??anos raksturo
Hunda likums
.
Elektronu sadal?juma atom? pa ?aul?m ?su pierakstu sauc par
elektronu konfigur?ciju
vai elektronformulu. Piem?ram,
sl?pek?a
atoma elektronu konfigur?cija ir 1
s
2
2
s
2
2
p
3
. Tas noz?m?, ka pirmaj? elektronu ?aul?
s
orbit?l? ir divi elektroni (?? ?aula ir piln?gi aizpild?ta un atbilst
h?lija
atoma konfigur?cijai), bet otraj? ?aul? atrodas 2 elektroni
s
orbit?l? un 3 elektroni
p
orbit?l?. Kop? sl?pek?a atomam ir 7 elektroni, kas atbilst t?
atomskaitlim
jeb vietas numuram
??misko elementu periodiskaj? tabul?
. Pieci no ?iem elektroniem atrodas ?r?j? ?aul?, t?d?j?di sl?pek?a maksim?l?
v?rt?ba
var b?t 5.
Ja atoms absorb? vai izstaro ener?ijas
kvantu
, main?s t? elektronu kvantu skait?i un elektronu m?ko?u forma.
- ↑
Nails Ahmetovs.
Neorganisk? ??mija
. R?ga : Zvaigzne, 1978, 9. lpp.
- ↑
J?zeps Eiduss, Uldis Zirn?tis.
Atomfizika
. R?ga: Zvaigzne, 1978, 59. lpp.
- ↑
Nails Ahmetovs.
Neorganisk? ??mija
. R?ga : Zvaigzne, 1978, 14. lpp.