Straipsnis i? Vikipedijos, laisvosios enciklopedijos.
| Metanas
|
|
| Sisteminis (
IUPAC
) pavadinimas
|
| Metanas
|
| CAS numeris
|
[74-82-8]
|
| InChI
|
1/CH4/h1H4
|
| Chemin? formul?
|
CH
4
|
| Molin? mas?
|
16,0425 g/mol
|
| SMILES
|
C
|
| R?g?tingumas (p
K
a
)
|
|
| Bazingumas (p
K
b
)
|
|
| Valentingumas
|
|
| Fizin? informacija
|
| Tankis
|
|
| I?vaizda
|
Bespalv?s dujos
|
| Lydymosi t°
|
-182,5 °C, 91 K,
|
| Virimo t°
|
-161,6 °C, 112 K,
|
| L??io rodiklis (
n
D
)
|
|
| Klampumas
|
|
| Tirpumas
H
2
O
|
3,5 mg/100 mL (17 °C)
|
| ?iluminis laidumas
|
|
| log P
|
|
| Garavimo sl?gis
|
|
| k
H
|
|
| Kritinis santykinis dr?gnumas
|
|
| Farmakokinetin? informacija
|
| Biotinkamumas
|
|
| Metabolizmas
|
|
| Pusam?is
|
|
| Pavojus
|
| MSDS
|
|
| ES klasifikacija
|
Ypa? degios (
F+
)
|
| NFPA 704
|
|
| ?ybsnio t°
|
-188 °C
|
| U?siliepsnojimo t°
|
|
| R-fraz?s
|
R12
|
| S-fraz?s
|
(S2), S9, S16, S33
|
| LD
50
|
|
| Strukt?ra
|
| Kristalin? strukt?ra
|
|
| Molekulin? forma
|
|
| Dipolio momentas
|
|
| Simetrijos grup?
|
|
| Termochemija
|
Δ
f
H
o
298
|
|
| Giminingi junginiai
|
| Giminingi
alkanai
|
Etanas
,
Propanas
|
| Giminingi junginiai
|
Metanolis
,
Chlorometanas
|
| Giminingos grup?s
|
|
- Apie Argentinos miest? ?i?r?kite:
San Chose de Metanas
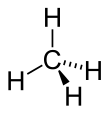
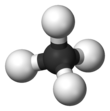
Metanas
? pats papras?iausias
alkan?
atstovas, kurio molekul?s formul?: CH
4
. Tai pagrindin?
gamtini? duj?
sudedamoji dalis. Sudegus vienai molekulei metano, susidaro viena molekul? CO
2
(
anglies dioksido
) ir dvi molekul?s H
2
O (
vandens
):
CH
4
+ 2O
2
→ CO
2
+ 2H
2
O.
Kadangi metanas yra labai paplit?s ir labai degus, jis pla?iai naudojamas kaip
kuras
.
?em?s plutoje
slypi dideli metano kiekiai. Taip pat nema?a metano dalis susidaro p?vant be oro
augal?
ir
gyv?n?
liekanoms.