β酸化
(ベ?タさんか)とは
脂肪酸
の
代謝
において脂肪酸を
酸化
して脂肪酸
アセチルCoA
(fatty acetyl-CoA; 脂肪酸と
補酵素A
の
チオエステル
)を生成し、そこから
アセチルCoA
を取り出す
代謝?路
のことである。β酸化は4つの
反?
の繰り返しから成り、反?が一順するごとにアセチルCoAが1
分子
生成され、最終生産物もアセチルCoAとなる。脂肪酸アシルCoAの
β位
において段階的な酸化が行われることからβ酸化と名付けられた。β酸化は脂肪酸の代謝の3つのステ?ジ(β酸化、
クエン酸回路
、
電子?達系
)の最初1つであり、生成されたアセチルCoAはクエン酸回路に送られ、CO
2
へと酸化される。
動物
細胞では脂肪酸から
エネルギ?
を取り出すための重要な代謝?路である。
植物
細胞においては
?芽
中の
種子
の中で主に見られる。
1904年
ヌ?プによって?見された。
脂肪酸の動員
[
編集
]
生物
がエネルギ?を取り出すために利用する脂肪酸や
グリセロ?ル
は、
脂肪細胞
に貯?された
トリアシルグリセロ?ル
などの
エステル
から得る
[1]
。トリアシルグリセロ?ルは
細胞
中に
脂質滴
として凝集しているため、
細胞質
の
浸透?
を上げることなく存在でき、また
水和
もされない。また同じ
質量
の
たんぱく質
や
糖質
の2倍以上の完全酸化エネルギ?(
有機物
を
二酸化炭素
と水まで酸化したときに得られるエネルギ?)を持っている
[2]
。このようにエネルギ?貯?物質としては極めて優れているが、その
水
に?する極端な不溶性は
酵素
によって代謝される際に障害となる。脂質滴のトリアシルグリセロ?ルをエネルギ?生産のために各組織(
骨格筋
、
心?
、腎皮質など)に運ぶ際は次の手順が踏まれる。
- ホルモン
感受性
リパ?ゼ
が脂質滴の表面に移動する。
- リパ?ゼによりトリアシルグリセロ?ルが
加水分解
され、脂肪酸が遊離する(
リン脂質
は
ホスホリパ?ゼ
により加水分解される)
- 血液中に出た脂肪酸が、可溶性タンパク質である
血?アルブミン
と結合し、不溶性が打ち消される。
- 血流に?って筋組織などに運ばれ、血?アルブミンから遊離した脂肪酸が脂肪酸トランスポ?タ?から細胞?に取り?まれる。
このように各細胞に取り?まれた後、脂肪酸の活性化、β酸化を?て、アセチルCoAが生成されるのである。
脂肪酸の活性化とミトコンドリア?への輸送
[
編集
]
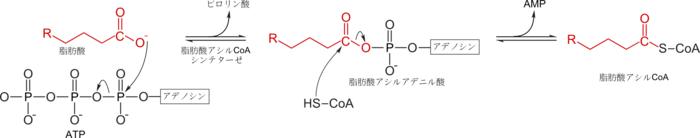 脂肪酸から脂肪酸アシルCoAへの?換
脂肪酸から脂肪酸アシルCoAへの?換
細胞?に取り?まれた脂肪酸は、その安定なC-C結合を克服するため、
ミトコンドリア外膜
の細胞質側に存在する酵素
アシルCoAシンテタ?ゼ
(acyl-CoA synthetase) により?媒され、次の反?によって活性化される。
脂肪酸 + CoA + ATP
 脂肪酸アシルCoA + AMP + PP
i
脂肪酸アシルCoA + AMP + PP
i
アシルCoAシンテタ?ゼは脂肪酸チオキナ?ゼ (fatty acid thiokinase)と も呼ばれる。この反?は2つのステップで起こる。まず脂肪酸の
カルボン酸
イオンが
ATP
の
リン酸
(β、γリン酸)と置換することで脂肪酸アシルアデニル酸 (fatty acyl adenylate) と
ピロリン酸
(PP
i
)が生成する。次に補酵素Aのチオ?ル基がアシル基の炭素を
求核攻?
し、脂肪酸アシルCoAとAMPを生成する。脂肪酸アシルCoAは高エネルギ?化合物の一種であり、脂肪酸と補酵素Aに加水分解したときの
標準自由エネルギ??化
は ΔG'°
 ?31 kJ/molである。生成した脂肪酸アシルCoAは
ミトコンドリア?膜
(植物の場合、
グリオキシソ?ム
という
細胞?小器官
の場合もある)に運搬され、β酸化を受けるか、若しくは細胞質ゾルでの膜脂質の合成に利用される。
?31 kJ/molである。生成した脂肪酸アシルCoAは
ミトコンドリア?膜
(植物の場合、
グリオキシソ?ム
という
細胞?小器官
の場合もある)に運搬され、β酸化を受けるか、若しくは細胞質ゾルでの膜脂質の合成に利用される。
ミトコンドリア?膜はアシルCoAを直接透過しないため、
カルニチン
(膜中に保持される補因子?物質、ビタミンB
T
といわれていたこともある)が脂肪酸アシル運搬?の役割を果たす(動植物共通)。脂肪酸アシルCoAはカルニチンと一時的に結合し、脂肪酸アシルカルニチンを生成する。この反?はミトコンドリア外膜に埋め?まれた
カルニチンアシルトランスフェラ?ゼI
(carnitine acyltransferase I) により?媒される。脂肪酸アシルカルニチンは
膜間スペ?ス
で生成される場合と外膜の細胞質ゾル側で生成する場合が考えられるが、今のところどちらの機構であるのかよく分かっていない。脂肪酸アシルカルニチンはアシルカルニチン/カルニチントランスポ?タ? (acyl-carnitine/ carnitine transporter) を介する促進?散により?膜を通過し、マトリックス?に移行する。そして脂肪酸アシル基が?面に局在する酵素
カルニチンアシルトランスフェラ?ゼII
(carnitine acyltransferase II) の?媒により、カルニチンからミトコンドリア?に存在する補酵素Aに?移されることで、脂肪酸アシルCoAが再生する。遊離のカルニチンはアシルカルニチン/カルニチントランスポ?タ?を介して再び膜間スペ?スへと移動する
[2]
。このような脂肪酸アシルCoAも輸送系を
カルニチンシャトル
という。ミトコンドリア?に入った脂肪酸アシルCoAはマトリックス?の酵素によって酸化を受ける。
β酸化反?および酵素群
[
編集
]
β酸化反?は4段階の反?の繰り返しからなり、一順する?に脂肪酸アシル鎖のカルボキシ末端から2炭素がアセチルCoAとして分離していく。たとえば
炭素?が偶?
の脂肪酸であるパルミチン酸 (C
16
) はパルミトイルCoAとしてミトコンドリア?で酸化を受け、これらの反?を7順し、アセチルCoA (CH
3
CO-S-
CoA
) を7分子生産する。さらに最後に?された2炭素もアセチルCoAであるため、反?全?では8分子のアセチルCoAが生産される。
炭素?が奇?
の脂肪酸も同じように反?が進み、アセチルCoAのほか、炭素?3個の
プロピオニルCoA
(CH
3
CH
2
CO-S-CoA) を生じる。このように、β酸化は炭素?に?わらず機能する。
β酸化の4つの酵素と前述
アシルCoAシンテタ?ゼ
を?じてβ酸化酵素群と呼ぶ。
- アシルCoAシンテタ?ゼ
(中鎖:EC6.2.1.2、長鎖:EC6.2.1.3)
- アシルCoAデヒドロゲナ?ゼ
(EC1.3.99.2、EC1.3.99.3)
- エノイルCoAヒドラタ?ゼ
(EC4.2.1.17)
- 3-ヒドロキシアシルCoAデヒドロゲナ?ゼ
(EC1.1.1.35)
- β-ケトアシルCoAチオラ?ゼ
(EC2.3.1.16)
アシルCoAデヒドロゲナ?ゼ以下4つの酵素が?媒するβ酸化の各段階について詳しく述べる。下記の反?は
in vivo
?では酸化方向のみに起こるが、
in vitro
では可逆的である。
段階1: FADによる酸化
[
編集
]

最初の段階は
アシルCoAデヒドロゲナ?ゼ
(acyl-CoA dehydrogenase) による酸化反?である。この反?においてα炭素とβ炭素の間に
二重結合
が形成され、
trans
-Δ
2
エノイルCoAができる。Δは二重結合の位置を表す。哺乳類には4種類のアシルCoAデヒドロゲナ?ゼの
アイソザイム
が存在し、それぞれ短鎖、中鎖、長鎖、超長鎖のアシル鎖に?して特異的に作用する
[1]
。二重結合が形成されることで電子がこれらの酵素の
補欠分子族
であるFADに移り、すぐにミトコンドリア呼吸鎖に送られる。
電子?達フラビンタンパク質
(ETF) と呼ばれる水溶性のタンパク質に結合した別のFADがこの電子を捕捉する
[2]
。
段階2: 水和
[
編集
]

第二の段階では、
エノイルCoAヒドラタ?ゼ
(enoyl-CoA hydratase) が?媒する反?により、前段階で形成された二重結合に
H
2
O
が付加され、β-ヒドロキシアシルCoA (β-hydroxyacyl-CoA, 3-hydroxyacyl-CoA) となる。この反?は
立?特異的
に進み、L?のみが生成する。
段階3: NAD
+
による酸化
[
編集
]

3段階目は
3-ヒドロキシアシルCoAデヒドロゲナ?ゼ
(3-hydroxyacyl-CoA dehydrogenase) が?媒する反?によってL-β-ヒドロキシアシルCoAが酸化され、β-ケトアシルCoA (β-ketoacyl-CoA) ができる。この酵素はβ-ヒドロキシアシルCoAのL?のみに作用する。この反?はNAD
+
依存である。NAD
+
に電子が移り、NADHができるが、その電子は電子?達系の複合?Ⅰに渡される
[2]
。
段階4: チオ?ル開裂
[
編集
]
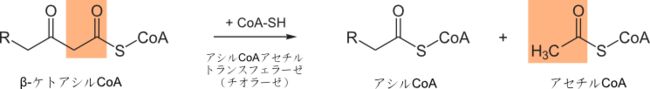
前3つは比較的安定なC-C結合を不安定化させるための反?である
[2]
。最後は
β-ケトアシルCoAチオラ?ゼ
(3-ketoacyl-CoA thiolase;
チオラ?ゼ
、
β-ケトチオラ?ゼ
、
アセチルCoA-アセチルトランスフェラ?ゼ
などとも) の?媒する反?により、β-ケトアシルCoAと
補酵素A
がチオ?ル開裂 (thiolysis) を起こし、2炭素分短くなった脂肪酸アシルCoAとアセチルCoAが生成する。補酵素Aのチオ?ル基 (-SH) がβ-ケトアシルCoAのカルボニル炭素を求核的に攻?することでα-β炭素間が開裂する。
炭素鎖が短くなった脂肪酸アシルCoAは次のβ酸化の第1段階の基質となり、脂肪酸アシル鎖の部分がすべてアセチルCoA (またはプロピニルCoA)に酸化されるまで反?は繰り返される。先ほど例に出したパルミチン酸では全?の反?式は次のように表せる。
- パルミトイルCoA + 7CoA + 7FAD + 7NAD
+
+ 7H
2
O
 8アセチルCoA + 7FADH
2
+ 7NADH + 7H
+
8アセチルCoA + 7FADH
2
+ 7NADH + 7H
+
プロピオニルCoAの酸化?路
[
編集
]
奇?個の炭素鎖を持つ脂肪酸の酸化では最後にプロピオニルCoA (C
3
) が生産される。プロピオニルCoAは別の代謝?路で?炭酸されてアセチルCoAとなり、クエン酸回路などの反?系に組み?まれる。また一部は
アラニン
合成に使用される。
プロピオニルCoAはまず
プロピオニルCoAカルボキシラ?ゼ
の作用でカルボキシ化され、D-
メチルマロニルCoA
が生成し、同時に1分子のATPが消費される。この酵素は補因子として
ビオチン
を含有する。この反?ではまずCO
2
(またはのそ水和型イオン
HCO
3
-
)がビオチンによって活性化さる。このエネルギ?はATPの
高エネルギ?リン酸結合
から得られる。?いて
D-メチルマロニルCoAエピメラ?ゼ
の作用により、D-メチルマロニルCoAがL-メチルマロニルCoAに?換される。そして
メチルマロニルCoAムタ?ゼ
の作用により、隣接する炭素原子の置換基(-S-CoA と -O
-
)が交換され、クエン酸回路で利用することのできる
スクシニルCoA
が生成される。この酵素は補酵素として
ビタミンB
12
に由?する5-デオキシアデノシルコバラミン(補酵素B
12
)を必要とする。また生成物の一部は
カタプレロティック反?
で取り除かれるため、すべてがクエン酸回路で代謝されるわけではない。
奇?個の炭素からなる脂肪酸は、主に植物やある種の海洋生物から見つかっている。また
ウシ
などの
反芻
動物は、第1胃で行われる
糖質
の
?酵
によって大量の
プロピオン酸
を生産する
[2]
。
不飽和脂肪酸の酸化?路
[
編集
]
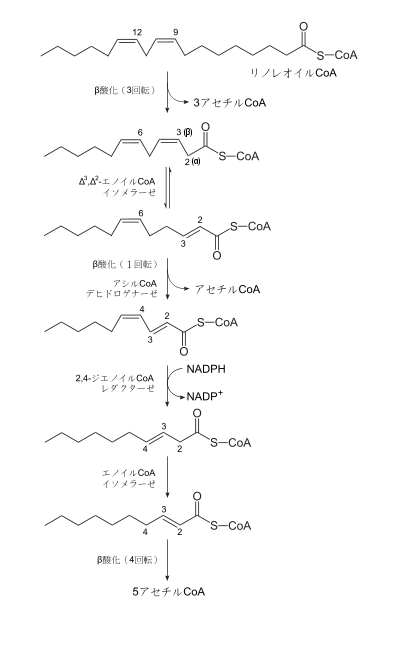 リノ?ル酸の酸化
リノ?ル酸の酸化
いままで?明したβ酸化の機構はパルミチン酸や
ステアリン酸
などの飽和脂肪酸 (炭素鎖が?結合のみでつながっている脂肪酸) のみに?てはまるものである。しかし、動物や植物のトリアシルグリセロ?ルやリン脂質に含まれる脂肪酸の多くは不飽和脂肪酸で、炭素鎖に1つ以上のシス型二重結合を持っている。しかし
エノイルCoAヒドラタ?ゼ
はΔ
2
-エノイルCoAのトランス型二重結合を水和する酵素であり、シス型の場合は基質になりえない。よって飽和脂肪酸の酸化に係わる4つの酵素のほかにさらに2種類の酵素が必要になる。この2つの酵素が?媒する反?について、cis-Δ
9
, cis-Δ
12
の二重結合を有するリノ?ル酸を例に?明する。
リノ?ル酸
はリノレオイルCoA (リノレイルCoA) としてβ酸化のサイクルに入り、一連の反?を3回通過して3分子のアセチルCoAと、cis-Δ
3
, cis-Δ
6
に二重結合をもつジエノイルCoA (C
12
) を生成する。そして
Δ
3
, Δ
2
エノイルCoAイソメラ?ゼ
(Δ
3
,Δ
2
-enoyl-CoA isomerase) の?媒する反?で異性化され、cis-Δ
3
二重結合がtrans-Δ
2
に?換される。こうして生成されたtrans,cis-Δ
2,6
ジエノイルCoAはβ酸化の酵素反?を一回受け、さらに第1段階の酵素であるアシルCoAデヒドロゲナ?ゼの作用を受けることで、trans,cis-Δ
2,4
ジエノイルCoA (C
10
) となる。このように2つの二重結合が1つの?結合によって隔てられた構造を
共役
ジエン
といい、電子の非局在化により安定化されている
[3]
。つまり水和しにくい。そこでNADPH依存性の
2,4-ジエノイルCoAレダクタ?ゼ
(2,4-dienoyl-CoA reductase) が?媒する還元反?によって、1個の二重結合をもつtrans-Δ
3
-エノイルCoAに?換される。この生成物はΔ
3
, Δ
2
エノイルCoAイソメラ?ゼの基質となる。こうしてまた二重結合がΔ
2
の位置に?換され、引き?きβ酸化の反?を通過する。最終的にアセチルCoAが9分子生産される
[1]
[4]
。
オレイン酸
(C
18
) など二重結合が1つだけある脂肪酸の場合、2,4-ジエノイルCoAレダクタ?ゼが?く必要がないため、エノイルCoAイソメラ?ゼによる異性化のみを受ける。また、二重結合がトランス型となっている
トランス脂肪酸
は異性化する必要すらなく、β酸化により代謝される。
β酸化の生理?的役割
[
編集
]
β酸化は最終産物として大量のアセチルCoAを生産するが、アセチルCoAは??な代謝系に用いられる汎用性に富んだ物質である。アセチルCoAの?う反?には以下のようなものがある。
このうち、主要代謝系がクエン酸回路の組み?みであり、パルミチン酸 (C16) 1分子が、クエン酸回路、電子?達系と酸化的リン酸化を?て完全酸化されることにより、
ATP
130分子が合成される。この代謝は?核細胞ではミトコンドリア?で、原核細胞では細胞質?で行われる。脂肪酸モル?りのATP合成量が糖などより多いことが良く理解できる(
グルコ?ス
の完全酸化では38分子程度)。
?連項目
[
編集
]
?考文?
[
編集
]