Antracena

|

|

|
| Nama
|
| Nama IUPAC
Anthracene;
Tricyclo[8.4.0.0
3,8
]tetradeca-1,3,5,7,9,11,13-heptaene
|
| Penanda
|
|
|
|
|
|
|
| 3DMet
|
{{{3DMet}}}
|
| ChEBI
|
|
| ChEMBL
|
|
| ChemSpider
|
|
| DrugBank
|
|
| Nomor EC
|
|
| KEGG
|
|
|
|
|
| Nomor RTECS
|
{{{value}}}
|
| UNII
|
|
|
|
|
InChI=1S/C14H10/c1-2-6-12-10-14-8-4-3-7-13(14)9-11(12)5-1/h1-10H
 Y Y
Key: MWPLVEDNUUSJAV-UHFFFAOYSA-N
 Y Y
InChI=1/C14H10/c1-2-6-12-10-14-8-4-3-7-13(14)9-11(12)5-1/h1-10H
Key: MWPLVEDNUUSJAV-UHFFFAOYAK
|
c3ccc2cc1ccccc1cc2c3
c1ccc2cc3ccccc3cc2c1
|
| Sifat
|
|
|
C
14
H
10
|
| Massa molar
|
178,23 g·mol
?1
|
| Penampilan
|
Tak berwarna
|
| Bau
|
Aromatik lemah
|
| Densitas
|
1.28 g/cm
3
(25 °C)
[1]
0.969 g/cm
3
(220 °C)
|
| Titik lebur
|
21.576 °C (38.869 °F; 21.849 K)
at 760 mmHg
[1]
|
| Titik didih
|
3.399 °C (6.150 °F; 3.672 K)
at 760 mmHg
[1]
|
|
|
0.022 mg/L (0 °C)
0.044 mg/L (25 °C)
0.287 mg/L (50 °C)
0.00045% w/w (100 °C, 3.9 MPa)
[1]
|
| Kelarutan
|
Larut dalam
alkohol
,
(C
2
H
5
)
2
O
,
aseton
,
C
6
H
6
,
CHCl
3
,
[1]
CS
2
[2]
|
| Kelarutan
dalam
etanol
|
0.076 g/100 g (16 °C)
1.9 g/100 g (19.5 °C)
0.328 g/100 g (25 °C)
[2]
|
| Kelarutan
dalam
metanol
|
1.8 g/100 g (19.5 °C)
[2]
|
| Kelarutan
dalam
heksana
|
0.37 g/100 g
[2]
|
| Kelarutan
dalam
toluena
|
0.92 g/100 g (16.5 °C)
12.94 g/100 g (100 °C)
[2]
|
| Kelarutan
dalam
karbon tetraklorida
|
0.732 g/100 g
[2]
|
| log P
|
4.56
[1]
|
| Tekanan uap
|
0.01 kPa (125.9 °C)
0.1 kPa (151.5 °C)
[1]
13.4 kPa (250 °C)
[3]
|
| k
H
|
0.039 L·atm/mol
[1]
|
| λ
maks
|
345.6 nm, 363.2 nm
[3]
|
| Konduktivitas termal
|
0.1416 W/m·K (240 °C)
0.1334 W/m·K (270 °C)
0.1259 W/m·K (300 °C)
[4]
|
| Viskositas
|
0.602 cP (240 °C)
0.498 cP (270 °C)
0.429 cP (300 °C)
[4]
|
| Struktur
|
|
|
Monoclinic
(290 K)
[5]
|
|
|
P2
1
/b
[5]
|
|
|
C
5
2h
[5]
|
|
|
a
= 8.562 A,
b
= 6.038 A,
c
= 11.184 A
[5]
α = 90°, β = 124.7°, γ = 90°
|
| Termokimia
|
| Kapasitas kalor
(
C
)
|
210.5 J/mol·K
[1]
[3]
|
Entropi molar standar
(
S
o
)
|
207.5 J/mol·K
[1]
[3]
|
Entalpi pembentukan standar
(Δ
f
H
o
)
|
129.2 kJ/mol
[1]
[3]
|
Entalpi
pembakaran
standar
Δ
c
H
o
298
|
7061 kJ/mol
[3]
|
| Bahaya
|
| Piktogram GHS
|
  [6] [6]
|
| Keterangan bahaya GHS
|
{{{value}}}
|
|
|
H315
,
H319
,
H335
,
H410
[6]
|
|
|
P261
,
P273
,
P305+351+338
,
P501
[6]
|
| Titik nyala
|
121 °C (250 °F; 394 K)
[6]
|
|
|
540 °C (1.004 °F; 813 K)
[6]
|
| Dosis atau konsentrasi letal (
LD
,
LC
):
|
|
|
4900 mg/kg (rats, oral)
|
|
|
 Y
verifikasi
(
apa ini Y
verifikasi
(
apa ini
 Y Y
 N
?) N
?)
|
| Referensi
|
|
|
|
Antrasena
adalah
hidrokarbon aromatis polisiklis
(PAH) dengan rumus molekul C
14
H
10
, yang terdiri dari tiga inti
benzena
. Merupakan komponen dari
coal tar
. Antracena digunakan pada
produksi
bahan pewarna
merah
alizarin dan bahan pewarna lainnya. Antracena tak berwarna tetapi memancarkan
fluoresensi
biru (puncak 400-500 nm ) di bawah sinar
ultraviolet
.
[8]
Coal tar, yang mengandung sekitar 1,5% antracena, merupakan sumber utama material ini. Ketakmurnian umum adalah
fenantrena
dan
carbazole
. Metode laboratorium klasik untuk preparasi of antracena adalah dengan siklodehidrasi
o
-metil- atau
o
-metilen- diarilketon yang dikenal dengan
reaksi Elbs
.
Antracena terdapat juga pada
medium antarbintang
.
[9]
Lebih dari 20%
karbon
di alam semesta ini dapat diasosiasikan dengan PAH, termasuk antracena.
[10]
Antracena mengalami dimerisasi
fotokimia
di bawah pengaru sinar
UV
:

Senyawa
dimernya
, disebut diantracena (atau terkadang disebut parantracena), dihubungkan melalui pasangan ikatan karbon-karbon baru, menghasilkan [4+4]
sikloadisi
. Ini dapat dikembalikan menjadi antrasena secara termal atau dengan radiasi
UV
bawah 300 nm. Derivat antracena tersubstitusi memiliki sifat yang serupa. Reaksi dipengaruhi dengan adanya
oksigen
.
[11]
[12]
Reduksi antracena dengan logam alkali menghasilkan radikal garam anion berwarna gelap M
+
[antracena]
-
(M = Li, Na, K). Hidrogenasi menghasilkan 9,10-
dihidroantracena
, dengan tetap mempertahankan aromatisitas cincin pengapitnya.
Oksidasi
kimia berlangsung cepat, menghasilkan
antraquinon
, C
14
H
8
O
2
(lihat di bawah), sebagai contoh, menggunakan
hidrogen peroksida
dan
vanadil asetilasetonat
.
[13]
 Anthraquione
Anthraquione
Antracena juga bereaksi dengan dienofile
oksigen singlet
pada reaksi [4+2]-sikloadisi (
Reaksi Diels-Alder
):
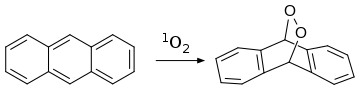 Diels alder reaction of anthracene with singlet oxygen
Diels alder reaction of anthracene with singlet oxygen
Antracena dikonversi terutama menjadi antraquinon, suatu prekursor zat pewarna.
[14]
Antracena, suatu
semikonduktor organik
dengan kesenjangan pita yang lebar digunakan sebagai
scintillator
pada detektor
foton
,
elektron
dan
partikel alfa
berenergi tinggi. Plastik seperti
polivinil toluena
, dapat diisi dengan antracena untuk memproduksi scintillator plastik yang digunakan untuk
dosimetri
radioterapi
. Puncak
spektrum emisi
antracena berkisar antara 400 nm dan 440 nm.
Antracena juga digunakan untuk
bahan pengawet
kayu
,
insektisida
, dan
bahan
pembungkus.
Antracena adalah salah satu dari tiga komponen (dua lainnya adalah kalium perklorat dan belerang) yang digunakan untuk memproduksi asap hitam selama
Papal Conclave
.
[15]
Berbagai macam derivat antracena digunakan untuk berbagai keperluan. Derivat dengan gugus hidroksil adalah 1-hidroksiantracena dan 2-hidroksiantracena (homolog
fenol
dan
naftol
). Hidroksiantracena (disebut juga antrol dan antracenol)
[16]
[17]
merupakan zat yang aktif secara
farmakologi
.
Dijumpai juga antracena dengan kandungan gugus hidroksil lebih dari satu, seperti pada
9,10-dihidroantracena
.
.
[18]
Anthracene, as many other PAHs, is generated during combustion processes: Exposure to humans happens mainly through tobacco smoke and ingestion of food contaminated with combustion products.
[19]
- ^
a
b
c
d
e
f
g
h
i
j
k
Lide, David R., ed. (2009).
CRC Handbook of Chemistry and Physics
(edisi ke-90).
Boca Raton, Florida
:
CRC Press
.
ISBN
978-1-4200-9084-0
.
- ^
a
b
c
d
e
f
Seidell, Atherton; Linke, William F. (1919).
Solubilities of Inorganic and Organic Compounds
(edisi ke-2nd). New York: D. Van Nostrand Company. hlm.
81
.
- ^
a
b
c
d
e
f
Anthracene
dalam Linstrom, P.J.; Mallard, W.G. (eds.)
NIST Chemistry WebBook, NIST Standard Reference Database Number 69
. National Institute of Standards and Technology, Gaithersburg MD.
http://webbook.nist.gov
(diakses tanggal 2014-06-22)
- ^
a
b
"Properties of Anthracene"
.
http://www.infotherm.com
. Wiley Information Services GmbH. Diarsipkan dari
versi asli
tanggal 2014-11-01
. Diakses tanggal
2014-06-22
.
- ^
a
b
c
d
Douglas, Bodie E.; Ho, Shih-Ming (2007).
Structure and Chemistry of Crystalline Solids
. New York: Springer Science+Business Media, Inc. hlm. 289.
ISBN
0-387-26147-8
.
- ^
a
b
c
d
e
Sigma-Aldrich Co.
,
Anthracene
. Diakses tanggal 2014-06-22.
- ^
"MSDS of Anthracene"
.
http://www.fishersci.ca
. Fisher Scientific
. Diakses tanggal
2014-06-22
.
- ^
Jonathan Lindsey and coworkers.
- ^
Iglesias-Groth, S.; Manchado, A.; Rebolo, R.; Gonzalez Hernandez, J. I.; Garcia-Hernandez, D. A.; Lambert, D. L. (May 2010).
- ^
Hoover, Rachel (February 21, 2014).
- ^
Rickborn, Bruce "The retro-Diels-Alder reaction.
- ^
Bouas-Laurent, Henri; Desvergne, Jean-Pierre; Castellan, Alain; Lapouyade, Rene "Photodimerization of anthracenes in fluid solution: structural aspects" Chemical Society Reviews (2000), vol. 29, pp. 43-55.
doi
:
10.1039/a801821i
[1]
- ^
Kimberly D. M. Charleton, Ernest M. Prokopchuk
Coordination Complexes as Catalysts: The Oxidation of Anthracene by Hydrogen Peroxide in the Presence of VO(acac)
2
Journal of Chemical Education 2011 88 (8), 1155-1157
doi
:
10.1021/ed100843a
[2]
- ^
Gerd Collin, Hartmut Hoke and Jorg Talbiersky "Anthracene" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2006.
doi
:
10.1002/14356007.a02_343.pub2
[3]
- ^
Vatican Radio, Briefing by Fr. Federico Lombardi, 03/13/2013, 1 p.m.
- ^
1-Hydroxyanthracene
NIST datapage
- ^
2-Hydroxyanthracene
NIST datapage
- ^
MSDS
- ^
http://www.cie.iarc.fr/htdocs/monographs/vol32/anthracene.html
[
pranala nonaktif permanen
]
|
|---|
| Umum
| |
|---|
| Perpustakaan nasional
| |
|---|
| Lain-lain
| |
|---|