 Boyle-Mariotteov zakon.
Boyle-Mariotteov zakon.
 Graf
originalnih rezultata koje je dobio
Robert Boyle
.
Graf
originalnih rezultata koje je dobio
Robert Boyle
.
Boyle-Mariotteov zakon
opisuje istodobnu
izotermnu
(
T
= konstantno) promjenu
tlaka
i
volumena
plina
. Volumen plina mijenja se s tlakom prema jednakosti:

odnosno:

za stalnu
temperaturu
(
T
= konstantno). Vrijednost konstante ovisi o temperaturi i koli?ini plina. Dakle, na stalnoj temperaturi
tlak
i
volumen
plina obrnuto su razmjerni u zatvorenom plinskom sustavu. U p-V dijagramu Boyle-Mariotteov zakon prikazuje se
izotermama
. Ovdje su to
hiperbole
s temperaturom
T
kao parametrom. Boyle-Mariotteov zakon vrijedi u potpunosti za
idealni plin
, dok za
realne plinove
pri visokim
tlakovima
nastaju manji otkloni.
[1]
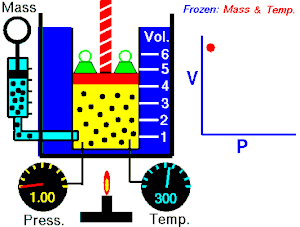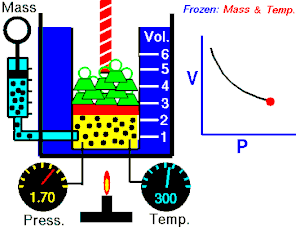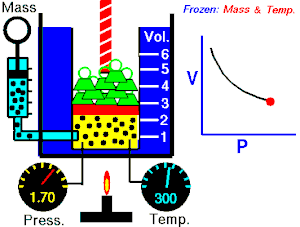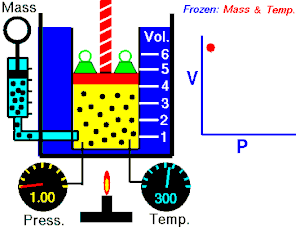
Imamo li u jednom
cilindru
koji je zatvoren
stapom
ili
klipom
neku koli?inu plina, on tla?i na stijenke posude. Kako plin nastoji da se ?iri na ?to ve?i
obujam
(
volumen
), moramo odozgo na stap staviti
uteg
?iji
tlak
mora biti jednak unutarnjem tlaku plina. Metnemo li na stap u cilindru ve?i uteg, obujam plina ?e se smanjiti, ali ?e mu se pove?ati tlak. To zna?i da se tlak plina zbog smanjenja obujma toliko pove?ao da je u stanju dr?ati
ravnote?u
vanjskom tlaku. Obratno, ako se vanjski tlak smanji, plin ?e se dotle ra?iriti, to jest pove?ati svoj obujam, dok stap u novom polo?aju ne bude opet u ravnote?i. To zna?i da je tlak plina zbog pove?anja obujma pao i izravnao se s vanjskim smanjenim tlakom. Navedeni
pokus
moramo vr?iti uz jednaku
temperaturu
. Temperaturu dr?imo stalno tako da cilindar stavimo u posudu kroz koju struji voda iste temperature.
Za plinove je uop?e svojstveno da mala promjena vanjskog tlaka izaziva veliku promjenu obujma, dok kod
krutih tijela
vrlo velika promjena tlaka izaziva malu promjenu obujma. Kako se mijenja obujam plina s tlakom, ustanovili su pokusima
Robert Boyle
i
Edme Mariotte
, neovisno jedan o drugome:

Ovaj izraz predstavlja Boyle-Mariotteov zakon koji glasi:

≫
Kod stalne temperature tlakovi određene koli?ine plina odnose se obrnuto razmjerno (proporcionalno) obujmima plina pri tim tlakovima.
≪
Takve promjene u stanju plinova koje se zbivaju kod iste temperature nazivaju se
izotermne promjene
.
Navedeni izraz mo?emo napisati i na drugi na?in:

ili op?enito:
[2]


≫
Kod izotermne promjene stanja plina, umno?ak tlaka i obujma određene koli?ine plina je stalna vrijednost.
≪
Ovaj zakon je nazvan po
irskom
znanstveniku i
filozofu
Robertu Boyleu
(1627. ? 1691.). Prvi put je izdan
1662.
Zakon je nastao nakon suradnje s dvojicom kolega znanstvenika amatera, Richardom Towneleyem i Henryjem Powerom, koji su ga i otkrili. Ovo pravilo se nazvalo po Boyleu jer je on
pokusima
dokazao i u javnost iznio pravilnu teoriju svojih kolega.
Prema Robertu Guntheru i ostalim autoritetima u
fizici
toga doba,
Robert Hooke
, izumitelj primitivnoga
mikroskopa
, mogao je također zna?ajno pridonijeti razvoju ovoga zakona, jer je bio napredniji
matemati?ar
od Boylea. Hooke je također pripremio
vakuumske
cijevi u svrhu pokusa.
Francuski
fizi?ar
Edme Mariotte
(1620. ? 1684.) otkrio je isti zakon u pribli?no isto vrijeme, pa se i u njegovu ?ast ovaj zakon ponekad zove
Boyle-Mariotteov zakon
. No, kako je ve? obja?njeno, Boyle je prvi dokazao teorijsku stranu ovoga pokusa, te je njegovo ime zna?ajnije u ovom slu?aju.
Boyleov zakon određuje da je umno?ak
obujma
i
tlaka
jednak konstantnom
idealnom plinu
, pod uvjetom da je
temperatura
konstantna
. Matemati?ki zapis ove jednad?be je:

gdje:
Vrijednost
k
je izra?unata iz mjerenja obujma i tlaka stalno iste koli?ine plina. Nakon promjene u sustavu, naj?e??e prisilnom promjenom u obujmu cijevi koje sadr?i istu koli?inu plina, novi obujam i novi tlak se mjere. Rezultat izra?unoga umno?ka novog tlaka i novog obujma bi trebali biti originalna vrijednost konstante
k
. Obujam
V
i tlak
p
su obrnuto proporcionalni: ve?i obujam zna?i manji tlak, te manji obujam zna?i ve?i tlak.
U dvije jednad?be ispod, o?ito je da su jednad?be povezane jednako??u, a govore da se, uz stalno istu koli?inu plina i istu temperaturu mijenjaju obujam i tlak proporcionalno:

U praksi se ova jednad?ba rje?ava na na?in da se iz jednad?be ispod odredi u?inak budu?e promjene u drugoj jednad?bi. Na primjer:

Boyleov,
Charlesov
i
Gay-Lussacov zakon
tvore
Zakon kombiniranih plinova
. Ova tri zakona u kombinaciji s
Avogadrovim zakonom
?ine
zakon idealnog plina
.
Sve dok je
temperatura
konstantna i koli?ina plina ograni?ena, a da su oboje uklju?eni u jednad?bu Boyleovog zakona,
k
je
konstantna
.
- ↑
Boyle-Mariotteov zakon
.
Hrvatska enciklopedija
. Leksikografski zavod Miroslav Krle?a. 2015.
- ↑
Velimir Kruz: "Tehni?ka fizika za tehni?ke ?kole", "?kolska knjiga" Zagreb, 1969.