La
senescencia celular
es el proceso iniciado como respuesta al
estres
y dano ocurrido en una celula, y constituye una ruta alternativa de respuesta a la
muerte celular programada
y es de vital importancia para suprimir la formacion de
celulas cancerosas
. Tambien esta asociada a la reparacion de tejidos e inflamacion de los mismos, procesos asociados al crecimiento de
tumores
. De esta manera, la senescencia celular esta asociada a los procesos de supresion y promocion de tumores simultaneamente, al igual que en el envejecimiento y reparacion de tejidos, roles que son diametralmente opuestos; sin embargo, de seguir el comportamiento in vitro, este proceso podria considerarse un ejemplo de
pleiotropia
antagonistica, donde un gen puede tener un impacto de adaptacion positivo en algunos rasgos y simultaneamente un impacto negativo sobre otros.
Historia
[
editar
]
Los procesos de senescencia celular fueron descritos por primera vez por
Leonard Hayflick
en su estudio sobre el crecimiento de
fibroblastos
humanos in vitro, donde encontro que en directa contravia de los postulados de
Alexis Carrel
(donde las celulas de mamiferos pueden crecer de manera infinita en cultivos in vitro), las celulas tienen un limite de crecimiento entre 40 y 60 ciclos de replicacion
[
1
]
El experimento consistia en mezclar dos cultivos de
fibroblastos
de diferentes "edades", un cultivo masculino que se encontraba en su cuadragesimo aumento al doble de poblacion y uno femenino que esta solo en el decimo. El cultivo mixto era comparado con dos cultivos de control sin mezclar, Hayflick y Morehead vieron que en el cultivo mixto, las celulas masculinas habian desaparecido despues de un tiempo, y postularon que estas celulas podian "recordar" su edad a pesar de estar rodeadas de celulas jovenes y se habian vuelto senescentes, con base exclusivamente en el numero de veces que se habian replicado.
[
2
]
En este primer articulo de Hayflick se pueden ver dos enunciados que seran fundamentales para el estudio futuro de la senescencia celular. En el primero declara que las unicas celulas somaticas que podrian escapar al proceso de senescencia son aquellas que han tomado las propiedades de celulas cancerigenas, y la segunda infiere la posibilidad de la senescencia celular en cultivos con el envejecimiento de seres vivos..
Definicion e identificacion de celulas senescentes
[
editar
]
Existe una serie de caracteristicas fisiologicas y moleculares que definen a una celula senescente y la diferencian de aquellas quiescentes y terminalmente diferenciadas. Las celulas entran en estado senescente principalmente en respuesta al dano oncogenico.
Estimulos de senescencia
[
editar
]
Es importante recordar que la senescencia celular es un proceso iniciado por distintos estimulos, y cualquiera de ellos o la combinacion de los mismos inicia el proceso.
El primer estimulo de senescencia conocido es el acortamiento de
telomeros
, debido a la ausencia de
telomerasa
en la mayor parte de las celulas somaticas. Durante la
fase S
de la replicacion celular se pierde una seccion del extremo de un
cromosoma
debido a la unidireccionalidad de las
ADN polimerasas
.
[
3
]
Por otra parte, estudios recientes han demostrado que la disfuncion telomerica inicia la senescencia al activar una senal de dano genetico persistente.
[
4
]
Esta senal puede producirse en varios sitios no telomericos del ADN de la celula, ya sea por el rompimiento de la doble helice,
[
5
]
por la presencia de compuestos como los inhibidores de la
histona deacetilasa
, que relaja la cromatina sin inducir dano en el ADN, o bien por el
supresor de tumores
p53, que pueden activar la proteina
ataxia telangiectasia mutada
(
ATM
), que inicia la respuesta de dano genetico.
Cuando se trabaja en condiciones in vitro, se observan fuentes diferentes de estres que inducen senescencia, tales como los sustratos inadecuados, suero (la celula experimenta plasma in vivo, no suero), y
estres oxidativo
(las condiciones atmosfericas son hiperfisiologicas).
[
6
]
La senescencia celular in vivo puede influir en las celulas de los tejidos circundantes y a nivel sistemico, al promover la inflamacion.
[
7
]
Fenotipo de la celula senescente
[
editar
]
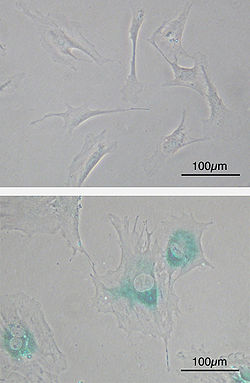 Senescencia celular
Celulas fibroblasticas embrionarias primarias de raton (FEM) antes de la senescencia. En forma de huso. (superior) Las EFM se vuelven senescentes al paso del tiempo. Las celulas se agrandan, se aplanan y expresan la senescencia asociada a la
β-galactosidasa
( areas azules), un marcador de la senescencia celular.
Senescencia celular
Celulas fibroblasticas embrionarias primarias de raton (FEM) antes de la senescencia. En forma de huso. (superior) Las EFM se vuelven senescentes al paso del tiempo. Las celulas se agrandan, se aplanan y expresan la senescencia asociada a la
β-galactosidasa
( areas azules), un marcador de la senescencia celular.
Aunque no todas las celulas senescentes presentan todas las caracteristicas fenotipicas descritas a continuacion, la presencia de cualquiera puede ser indicio suficiente para declarar el estado senescente.
- Aumento del tamano de la celula, algunas veces hasta el doble del tamano original. Esta primera caracteristica de la senescencia celular fue descubierta por Hayflick.
- Aumento de la
β-galactosidasa
, producto de cambios en el
compartimiento lisosomal
, que aumenta su tamano, lo que incrementa los niveles enzimaticos a un punto tal que la actividad de la β-galactosidasa puede ser detectada a pH 6.0 (suboptimo), y llega a niveles mucho mas altos que los codificados regularmente por el gen
GLB1
,
[
8
]
la presencia de niveles aumentados de β-galactosidasa es detectada por tincion histoquimica en la mayor parte de las celulas.
- Expresion de
inhibidores kinasas ciclin-dependientes
(
CDKi
, en ingles)
p16INK4a
y
p21WAF1
: son capaces de activar procesos de senescencia sin activar la respuesta de dano genetico comun al proceso.
[
9
]
Estos inhibidores son parte de las rutas de supresion de tumores asociadas a las proteinas p53 y a la
proteina de retinoblastoma
(
pRB
), que crean focos de
heterocromatina
asociados a la senescencia (
SAHF
, en ingles), lo que silencia
genes pro-proliferacion
.
[
10
]
Estos inhibidores aumentan en cantidad con el paso de los anos y se ha visto que estan vinculados con la disminucion de celulas progenitoras en multiples tejidos. Es importante hacer notar que la mayor parte de las celulas cancerigenas poseen defectos en las rutas mencionadas (pRB y p53), las celulas senescentes pueden identificarse facilmente por medio de las proteinas
HIRA
y
HP1β
, que se observan exclusivamente en SAHF y que no estan asociadas a ninguna otra patologia.
- El ADN de celulas senescentes tambien presenta alteraciones en la cromatina que refuerzan la senescencia (
SCARS
). Estos focos tiene proteinas de dano persistente activadas como las
fosfo-ATM
y
ataxia telangiectasia
, y se pueden distinguir de los focos de danos transitorios y habitualmente incluyen telomeros disfuncionales.
Senescencia y envejecimiento
[
editar
]
Existe una fuerte relacion entre la senescencia celular y el envejecimiento. Varios estudios se han centrado especialmente en el papel de la proteina
p53
. En pruebas en ratones que fueron modificados para producir niveles altos de p53 se encontraron dos resultados muy disimiles: un grupo presentaba tasas de cancer casi inexistentes, ya que p53 es un supresor de tumores, pero su vida media era significativamente mas corta y presentaban sintomas de envejecimiento a edades tempranas. Esto llevo a determinar la correlacion entre las altas tasas de senescencia celular y el envejecimiento,
[
11
]
pero, de manera paralela, algunos ratones que tenian una modificacion que hacia que los niveles de p53 solo fueran mas altos despues de la activacion natural de la respuesta de senescencia, tenian la misma tasa de resistencia al cancer, pero una longitud de vida normal, las proteinas p53 reguladas naturalmente interactuaban con un efecto opuesto a las no reguladas,
[
12
]
lo que mostro la influencia de otros factores fisiologicos sobre los procesos de senescencia celular.
Restriccion calorica y senescencia (envejecimiento)
[
editar
]
Distintos factores fisiologicos pueden afectar las tasas de envejecimiento de un ser vivo. La restriccion calorica es una de ellas, al limitar la cantidad de calorias disponibles sin caer en la desnutricion. Distintos modelos han aumentado su expectativa de vida promedio,
[
13
]
Este proceso parece estar asociado a la actividad de genes reguladores de informacion silenciosa, o
sirtuinas
, que codifican la produccion de
deacetilasas NAD
dependientes en formas de vida menores como
C. elegans
y que pueden tener formas homologas en mamiferos.
Se determino que ortologos de sirtuina 2 son necesarios para que la restriccion calorica tenga un efecto de aumento de longevidad en
C. elegans
, y su ortologo en mamiferos, la sirtuina T1, se encuentra en mayor cantidad en tejidos de mamiferos con restriccion calorica. La relacion aun no se ha confirmado en mamiferos.
[
14
]
La hipotesis principal detras de esta correlacion fue del
laboratorio Guarente
, donde se postula que en condiciones de restriccion dietaria existe un cambio metabolico de fermentacion a respiracion,
[
15
]
lo que aumenta los niveles de
NAD
+ intracelular, lo cual aumentaria la actividad de la sirtuina 2. Sin embargo, esta hipotesis haria imposible el aumento de la expectativa de vida de organismos que sean incapaces de llevar a cabo ese cambio metabolico.
Referencias
[
editar
]
- ↑
Hayflick, L. (Marzo de 1965).
≪The limited in vitro lifetime of human diploid cell strains≫
.
Experimental Cell Research
37
: 614-636.
ISSN
0014-4827
.
PMID
14315085
.
doi
:
10.1016/0014-4827(65)90211-9
. Consultado el 21 de marzo de 2023
.
- ↑
Shay, J. W.; Wright, W. E. (Octubre de 2000).
≪Hayflick, his limit, and cellular ageing≫
.
Nature Reviews. Molecular Cell Biology
1
(1): 72-76.
ISSN
1471-0072
.
PMID
11413492
.
doi
:
10.1038/35036093
. Consultado el 21 de marzo de 2023
.
- ↑
Campisi, Judith (25 de febrero de 2005).
≪Senescent cells, tumor suppression, and organismal aging: good citizens, bad neighbors≫
.
Cell
120
(4): 513-522.
ISSN
0092-8674
.
PMID
15734683
.
doi
:
10.1016/j.cell.2005.02.003
. Consultado el 21 de marzo de 2023
.
- ↑
Nakamura, Asako J.; Chiang, Y. Jeffrey; Hathcock, Karen S.; Horikawa, Izumi; Sedelnikova, Olga A.; Hodes, Richard J.; Bonner, William M. (3 de noviembre de 2008).
≪Both telomeric and non-telomeric DNA damage are determinants of mammalian cellular senescence≫
.
Epigenetics & Chromatin
1
(1): 6.
ISSN
1756-8935
.
PMC
2584625
.
PMID
19014415
.
doi
:
10.1186/1756-8935-1-6
. Consultado el 21 de marzo de 2023
.
- ↑
Di Leonardo, A.; Linke, S. P.; Clarkin, K.; Wahl, G. M. (1 de noviembre de 1994).
≪DNA damage triggers a prolonged p53-dependent G1 arrest and long-term induction of Cip1 in normal human fibroblasts≫
.
Genes & Development
8
(21): 2540-2551.
ISSN
0890-9369
.
PMID
7958916
.
doi
:
10.1101/gad.8.21.2540
. Consultado el 21 de marzo de 2023
.
- ↑
Parrinello, Simona; Samper, Enrique; Krtolica, Ana; Goldstein, Joshua; Melov, Simon; Campisi, Judith (Agosto de 2003).
≪Oxygen sensitivity severely limits the replicative lifespan of murine fibroblasts≫
.
Nature Cell Biology
5
(8): 741-747.
ISSN
1465-7392
.
PMC
4940195
.
PMID
12855956
.
doi
:
10.1038/ncb1024
. Consultado el 21 de marzo de 2023
.
- ↑
Lyamina, S.; Baranovskii, D.; Kozhevnikova, E.; Ivanova, T.; Kalish, S.; Sadekov, T.; Klabukov, I.; Maev, I.
et al.
(2023).
≪Mesenchymal Stromal Cells as a Driver of Inflammaging≫
.
International Journal of Molecular Sciences
24
(7): 6372.
ISSN
1422-0067
.
PMC
10094085
.
PMID
37047346
.
doi
:
10.3390/ijms24076372
. Consultado el 28 de marzo de 2024
.
- ↑
Lee, Bo Yun; Han, Jung A.; Im, Jun Sub; Morrone, Amelia; Johung, Kimberly; Goodwin, Edward C.; Kleijer, Wim J.; DiMaio, Daniel
et al.
(Abril de 2006).
≪Senescence-associated beta-galactosidase is lysosomal beta-galactosidase≫
.
Aging Cell
5
(2): 187-195.
ISSN
1474-9718
.
PMID
16626397
.
doi
:
10.1111/j.1474-9726.2006.00199.x
. Consultado el 21 de marzo de 2023
.
- ↑
Rodier, Francis; Coppe, Jean-Philippe; Patil, Christopher K.; Hoeijmakers, Wieteke A. M.; Munoz, Denise P.; Raza, Saba R.; Freund, Adam; Campeau, Eric
et al.
(Agosto de 2009).
≪Persistent DNA damage signalling triggers senescence-associated inflammatory cytokine secretion≫
.
Nature Cell Biology
11
(8): 973-979.
ISSN
1476-4679
.
PMC
2743561
.
PMID
19597488
.
doi
:
10.1038/ncb1909
. Consultado el 21 de marzo de 2023
.
- ↑
Narita, Masashi; N?nez, Sabrina; Heard, Edith; Narita, Masako; Lin, Athena W.; Hearn, Stephen A.; Spector, David L.; Hannon, Gregory J.
et al.
(13 de junio de 2003).
≪Rb-mediated heterochromatin formation and silencing of E2F target genes during cellular senescence≫
.
Cell
113
(6): 703-716.
ISSN
0092-8674
.
PMID
12809602
.
doi
:
10.1016/s0092-8674(03)00401-x
. Consultado el 21 de marzo de 2023
.
- ↑
Hinkal, George W.; Gatza, Catherine E.; Parikh, Neha; Donehower, Lawrence A. (Abril de 2009).
≪Altered senescence, apoptosis, and DNA damage response in a mutant p53 model of accelerated aging≫
.
Mechanisms of Ageing and Development
130
(4): 262-271.
ISSN
1872-6216
.
PMC
2722837
.
PMID
19396980
.
doi
:
10.1016/j.mad.2009.01.001
. Consultado el 21 de marzo de 2023
.
- ↑
de Keizer, Peter L. J.; Laberge, Remi-Martin; Campisi, Judith (Julio de 2010).
≪p53: Pro-aging or pro-longevity?≫
.
Aging
2
(7): 377-379.
ISSN
1945-4589
.
PMC
2933881
.
PMID
20657035
.
doi
:
10.18632/aging.100178
. Consultado el 21 de marzo de 2023
.
- ↑
Colman, Ricki J.; Anderson, Rozalyn M.; Johnson, Sterling C.; Kastman, Erik K.; Kosmatka, Kristopher J.; Beasley, T. Mark; Allison, David B.; Cruzen, Christina
et al.
(10 de julio de 2009).
≪Caloric restriction delays disease onset and mortality in rhesus monkeys≫
.
Science (New York, N.Y.)
325
(5937): 201-204.
ISSN
1095-9203
.
PMC
2812811
.
PMID
19590001
.
doi
:
10.1126/science.1173635
. Consultado el 21 de marzo de 2023
.
- ↑
Cohen, Haim Y.; Miller, Christine; Bitterman, Kevin J.; Wall, Nathan R.; Hekking, Brian; Kessler, Benedikt; Howitz, Konrad T.; Gorospe, Myriam
et al.
(16 de julio de 2004).
≪Calorie restriction promotes mammalian cell survival by inducing the SIRT1 deacetylase≫
.
Science (New York, N.Y.)
305
(5682): 390-392.
ISSN
1095-9203
.
PMID
15205477
.
doi
:
10.1126/science.1099196
. Consultado el 21 de marzo de 2023
.
- ↑
Lin, Su-Ju; Kaeberlein, Matt; Andalis, Alex A.; Sturtz, Lori A.; Defossez, Pierre-Antoine; Culotta, Valeria C.; Fink, Gerald R.; Guarente, Leonard (18 de julio de 2002).
≪Calorie restriction extends Saccharomyces cerevisiae lifespan by increasing respiration≫
.
Nature
418
(6895): 344-348.
ISSN
0028-0836
.
PMID
12124627
.
doi
:
10.1038/nature00829
. Consultado el 21 de marzo de 2023
.