 Etapas del proceso de precipitacion, de izquierda a derecha: solucion sobresaturada, suspension y solucion saturada con precipitado en la parte inferior.
Etapas del proceso de precipitacion, de izquierda a derecha: solucion sobresaturada, suspension y solucion saturada con precipitado en la parte inferior.
 Al mezclar una solucion de
sulfato cuprico
(CuSO4) con una de
hidroxido sodico
(NaOH), se forma
sulfato de sodio
(Na2SO4) e
hidroxido de cobre
(II) (Cu(OH)2), que al ser insoluble se precipita.
Al mezclar una solucion de
sulfato cuprico
(CuSO4) con una de
hidroxido sodico
(NaOH), se forma
sulfato de sodio
(Na2SO4) e
hidroxido de cobre
(II) (Cu(OH)2), que al ser insoluble se precipita.
La
precipitacion
es la creacion de un
solido
a partir de una
solucion
. Cuando la reaccion ocurre en una solucion
liquida
, el solido formado se llama '
precipitado
'. La
sustancia quimica
que hace que se forme el solido se llama 'precipitante'. Sin suficiente fuerza gravitatoria (
sedimentacion
) para unir las particulas solidas, el precipitado permanece en suspension. Despues de la sedimentacion, especialmente cuando se usa una
centrifugadora
para presionarla en una masa compacta, el precipitado puede denominarse "granulo". La precipitacion se puede utilizar como medio. El liquido libre de precipitados que queda por encima del solido se llama "sobrenadante". Los polvos derivados de la precipitacion tambien se conocen historicamente como 'flores'. Cuando el solido aparece en forma de fibras de celulosa que han sido sometidas a un procesamiento quimico, el proceso a menudo se denomina
regeneracion
.
A veces, la formacion de un precipitado indica la aparicion de una reaccion quimica. Si la solucion de
nitrato de plata
se vierte en una solucion de
cloruro de sodio
, se produce una reaccion quimica que forma un precipitado blanco de
cloruro de plata
. Cuando la solucion de
yoduro de potasio
reacciona con la solucion de
nitrato de plomo
(II), se forma un precipitado amarillo de
yoduro de plomo
(II).
La precipitacion puede ocurrir si la concentracion de un compuesto excede su solubilidad (como al mezclar solventes o cambiar su temperatura). La precipitacion tambien puede ocurrir rapidamente de una solucion
sobresaturada
.
En los solidos, la precipitacion ocurre si la concentracion de un solido esta por encima del limite de solubilidad en el solido huesped, debido a, p. enfriamiento rapido o implantacion de iones, y la temperatura es lo suficientemente alta como para que la difusion pueda conducir a la segregacion en precipitados. La precipitacion en solidos se usa habitualmente para sintetizar nanoclusters.
[
1
]
Una etapa importante del proceso de precipitacion es el inicio de la
nucleacion
. La creacion de una particula solida hipotetica incluye la formacion de una interfaz, que requiere algo de energia basada en la energia de superficie relativa del solido y la solucion. Si esta energia no esta disponible y no hay disponible una superficie de nucleacion adecuada, se produce sobresaturacion.
Aplicaciones
[
editar
]
Las reacciones de precipitacion se pueden usar para hacer
pigmentos
, eliminar sales del agua en el
tratamiento del agua
y en el analisis inorganico
cualitativo
clasico.
La precipitacion tambien es util para aislar los productos de una reaccion durante el tratamiento. Idealmente, el producto de la reaccion es insoluble en el disolvente de reaccion. Por lo tanto, precipita a medida que se forma, preferiblemente formando
cristales
puros. Un ejemplo de esto seria la
sintesis
de
porfirinas
en
acido propionico
a reflujo. Al enfriar la mezcla de reaccion a temperatura ambiente, precipitan los cristales de la porfirina y se recogen por filtracion:
[
2
]

La precipitacion tambien puede ocurrir cuando se agrega un antidisolvente (un solvente en el cual el producto es insoluble), reduciendo drasticamente la solubilidad del producto deseado. Posteriormente, el precipitado se puede separar facilmente por filtracion,
decantacion
o
centrifugacion
. Un ejemplo seria la sintesis de cloruro de tetrafenilporfirina cromico: se agrega agua a la solucion de reaccion de DMF y el producto precipita.
[
3
]
La precipitacion tambien es util para purificar productos: el bmim-Cl crudo se recoge en
acetonitrilo
y se vierte en
acetato de etilo
, donde precipita.
[
4
]
Otra aplicacion importante de un antidisolvente es la precipitacion de
ADN
en
etanol
.
En la
metalurgia
, la precipitacion de una solucion solida tambien es una forma util de fortalecer las
aleaciones
; Este proceso se conoce como fortalecimiento de la solucion solida.
Precipitado antigenico
[
editar
]
En
inmunologia
, las reacciones de precipitacion son las mas simples de realizar y visualizar, al hacer reaccionar un
antigeno
soluble con un
anticuerpo
correspondiente.
[
5
]
Al antigeno en cuestion se le llama
precipitogeno
, es multivalente (posee varias copias del mismo
determinante antigenico
) y puede ser de naturaleza
proteica
,
toxinas
u otros productos de
bacterias
,
hongos
,
virus
, etc. Al anticuerpo se le llama
precipitina
y por lo general pertenece a las
IgG
. Estas reacciones son comunes en los laboratorios de diagnostico, que usan medios liquidos o solidos (
agar
) para realizar la prueba, util, por ejemplo en el examen de
VDRL
para el diagnostico de
sifilis
congenita, o en la
inmunodifusion doble de Ouchterlony
.
[
6
]
Precipitacion quimica
[
editar
]
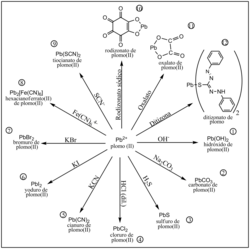 Reacciones de precipitacion del
Plomo (II)
.
Reacciones de precipitacion del
Plomo (II)
.
Mediante la adicion de
reactivos
, los
contaminantes
solubles
se transforman en formas insolubles o de una menor solubilidad. La eliminacion de la disolucion sera tanto mas completa (cuantitativa) cuanto mas insoluble sea el compuesto formado. Por ejemplo, se pueden eliminar los
bicarbonatos
del agua mediante la adicion de
hidroxido de calcio
, Ca(OH)
2
, el cual forma
carbonato de calcio
, CaCO
3
, compuesto poco soluble que sedimenta en forma de fino polvo.
[
7
]
Es la tecnologia de pretratamiento mas comun para la eliminacion de contaminantes que se utiliza para reducir la concentracion de
metales
en el
agua residual
a niveles que no causen preocupacion. Es posible eliminar un
metal pesado
disuelto (como
plomo
,
mercurio
,
cobre
o
cadmio
, que este como
cloruro
,
nitrato
o
sulfato
) adicionando
hidroxido de sodio
o de calcio, que produce la precipitacion del correspondiente hidroxido de plomo, mercurio, cobre o cadmio. Tambien se utiliza para eliminar la
dureza del agua
, tecnica llamada ablandamiento.
Representacion mediante ecuaciones quimicas
[
editar
]
Un ejemplo de reaccion de precipitacion: se agrega
nitrato de plata
acuoso (AgNO3) a una solucion que contiene
cloruro de potasio
(KCl), se observa la precipitacion de un solido blanco,
cloruro de plata
(AgCl). (Zumdahl, 2005)

El cloruro de plata (AgCl) ha formado un solido, que se observa como un precipitado.
Esta reaccion se puede escribir enfatizando los
iones disociados
en una solucion combinada. Esto se conoce como ecuacion ionica.

Una forma final de representar una reaccion de precipitado se conoce como
ecuacion ionica neta
o
reaccion ionica neta
.
Colores de precipitados
[
editar
]
 Manchas de color verde y marron rojizo en una muestra de nucleo de piedra caliza, correspondientes respectivamente a precipitados de oxidos/hidroxidos de
Fe
2+
Manchas de color verde y marron rojizo en una muestra de nucleo de piedra caliza, correspondientes respectivamente a precipitados de oxidos/hidroxidos de
Fe
2+
y
Fe
3+
Muchos compuestos que contienen iones metalicos producen precipitados con colores distintivos. Los siguientes son colores tipicos para varios metales. Sin embargo, muchos de estos compuestos pueden producir colores muy diferentes a los enumerados.
Otros compuestos generalmente forman precipitados blancos.
Analisis de aniones/cationes
[
editar
]
La formacion de precipitados es util en la deteccion del tipo de
cation
en una
sal
. Para hacer esto, un
base
reacciona primero con la sal desconocida para producir un precipitado que es el
hidroxido
de la sal desconocida. Para identificar el cation se anota el color del precipitado y su solubilidad en exceso. A menudo se utilizan procesos similares en secuencia; por ejemplo, una solucion de
nitrato de bario
reaccionara con
iones
de
sulfato
para formar un precipitado de
sulfato de bario
solido, lo que indica que es probable que haya iones de sulfato presentes.
Digestion
[
editar
]
La digestion, o
envejecimiento del precipitad
o, ocurre cuando se deja un precipitado recien formado, generalmente a una
temperatura
mas alta, en la solucion de la que precipita. Da como resultado particulas mas limpias y mas grandes. El proceso fisico-quimico subyacente a la digestion se llama
maduracion de Ostwald
.
Vease tambien
[
editar
]
Referencias
[
editar
]
- ↑
Dhara, S. (2007). ≪Formation, Dynamics, and Characterization of Nanostructures by Ion Beam Irradiation≫.
Critical Reviews in Solid State and Materials Sciences
32
(1): 1-50.
Bibcode
:
2007CRSSM..32....1D
.
doi
:
10.1080/10408430601187624
.
- ↑
A. D. Adler; F. R. Longo; J. D. Finarelli; J. Goldmacher; J. Assour; L. Korsakoff (1967). ≪A simplified synthesis for meso-tetraphenylporphine≫.
J. Org. Chem.
32
(2): 476-476.
doi
:
10.1021/jo01288a053
.
- ↑
Alan D. Adler; Frederick R. Longo; Frank Kampas; Jean Kim (1970). ≪On the preparation of metalloporphyrins≫.
Journal of Inorganic and Nuclear Chemistry
32
(7): 2443.
doi
:
10.1016/0022-1902(70)80535-8
.
- ↑
Dupont, J., Consorti, C., Suarez, P., de Souza, R. (2004). "
Preparation of 1-Butyl-3-methyl imidazolium-based Room Temperature Ionic Liquids
".
Org. Synth.
;
Coll. Vol.
10
: 184.
- ↑
≪Reaccion antigeno-anticuerpo≫
. Consultado el 20 de agosto de 2014
.
- ↑
≪Ensayos inmunologicos≫
. Consultado el 20 de agosto de 2014
.
- ↑
≪Precipitacion. Tecnicas≫
. Consultado el 20 de agosto de 2014
.
Enlaces externos
[
editar
]