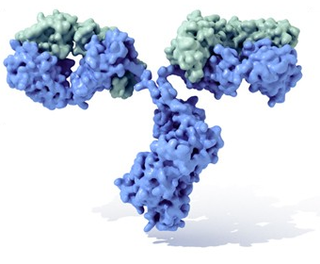
 Molecula
de inmunoglobulina con su tipica forma de Y. En azul se observan las
cadenas pesadas
con cuatro dominios Ig, mientras que en verde se muestran las
cadenas ligeras
. Entre el tallo (Fraccion constante, Fc) y las ramas (Fab) existe una parte mas delgada conocida como "region bisagra" (
hinge
, en ingles).
Molecula
de inmunoglobulina con su tipica forma de Y. En azul se observan las
cadenas pesadas
con cuatro dominios Ig, mientras que en verde se muestran las
cadenas ligeras
. Entre el tallo (Fraccion constante, Fc) y las ramas (Fab) existe una parte mas delgada conocida como "region bisagra" (
hinge
, en ingles).
Los
anticuerpos
, (en la ciencia
inmunoglobulinas
Ig) son
glucoproteinas
del tipo
gamma globulina
. Pueden encontrarse de forma soluble en la
sangre
y los otros fluidos corporales de los
vertebrados
, disponiendo de una forma identica que actua como
receptor de membrana
en los
linfocitos B
y son empleados por el
sistema inmunitario
para identificar y neutralizar elementos extranos tales como
bacterias
y
virus
.
[
1
]
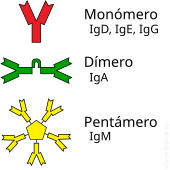
El anticuerpo tipico esta constituido por dos unidades estructurales basicas, cada una de ellas con dos grandes
cadenas pesadas
y dos
cadenas ligeras
de menor tamano, que forman, por ejemplo,
monomeros
con una unidad,
dimeros
con dos unidades o pentameros con cinco unidades. Los anticuerpos son sintetizados por un tipo de
leucocito
denominado
linfocito B
. Existen distintas modalidades de anticuerpo,
isotipos
, basadas en la forma de cadena pesada que posean. Se conocen cinco clases diferentes de isotipos en
mamiferos
que desempenan funciones diferentes, contribuyendo a dirigir la respuesta inmune adecuada para cada distinto tipo de cuerpo extrano que encuentran.
[
2
]
Aunque la estructura general de todos los anticuerpos es muy semejante, una pequena region del apice de la
proteina
es extremadamente variable, lo cual permite la existencia de millones de anticuerpos, cada uno con un extremo ligeramente distinto. A esta parte de la proteina se la conoce como region hipervariable. Cada una de estas variantes se puede unir a una "diana" distinta, que es lo que se conoce como
antigeno
.
[
3
]
Esta enorme diversidad de anticuerpos permite al sistema inmune reconocer una diversidad igualmente elevada de
antigenos
. La unica parte del antigeno reconocida por el anticuerpo se denomina
epitopo
. Estos epitopos se unen con su anticuerpo en una interaccion altamente especifica que se denomina
adaptacion inducida
, que permite a los anticuerpos identificar y unirse solamente a su antigeno unico en medio de los millones de moleculas diferentes que componen un
organismo
.
El reconocimiento de un antigeno por un anticuerpo lo
marca
para ser atacado por otras partes del
sistema inmunitario
. Los anticuerpos tambien pueden neutralizar sus objetivos directamente, mediante, por ejemplo, la union a una porcion de un
patogeno
necesaria para que este provoque una
infeccion
.
La extensa poblacion de anticuerpos y su diversidad se genera por combinaciones al azar de un juego de segmentos
geneticos
que codifican diferentes lugares de union al antigeno (o
paratopos
), que posteriormente sufren
mutaciones
aleatorias en esta zona del gen del anticuerpo, lo cual origina una diversidad aun mayor.
[
2
]
[
4
]
Los genes de los anticuerpos tambien se reorganizan en un proceso conocido como
conmutacion de clase de inmunoglobulina
que cambia la base de la cadena pesada por otra, creando un isotipo de anticuerpo diferente que mantiene la region variable especifica para el antigeno diana. Esto posibilita que un solo anticuerpo pueda ser usado por las diferentes partes del sistema inmune. La produccion de anticuerpos es la funcion principal del
sistema inmunitario humoral
.
[
5
]
Los anticuerpos , que son unas proteinas que forman parte del sistema inmune , circulan por sangre. Cuando reconocen sustancias extranas para el organismo, como los virus y las bacterias o sus toxinas , las neutralizan.
Anticuerpos, inmunoglobulinas y gammaglobulinas
[
editar
]
En general, como ya se dijo en la introduccion, se considera que anticuerpo e inmunoglobulina son equivalentes, haciendo referencia el primer termino a la funcion, mientras que el segundo alude a la estructura. El termino gammaglobulina se debe a las propiedades
electroforeticas
de las inmunoglobulinas solubles en
suero
, si bien algunas inmunoglobulinas migran con las fracciones alfa, beta e incluso con la
albumina
.
En 1890 comenzo el estudio de los anticuerpos cuando
Emil Adolf von Behring
y
Shibasaburo Kitasato
describieron la actividad de los anticuerpos contra la
difteria
y la
toxina tetanica
. Behring y Kitasato propusieron la teoria de la
inmunidad humoral
, que establecia la existencia de un mediador en el
suero sanguineo
que podria reaccionar con un antigeno extrano, dandole el nombre de anticuerpo.
[
6
]
[
7
]
Su idea llevo en 1897 a
Paul Ehrlich
a proponer la
teoria de la cadena lateral
de la interaccion entre antigeno y anticuerpo y a lanzar la hipotesis de que existian receptores (descritos como "cadenas laterales") en la superficie de las celulas que se podrian unir especificamente a
toxinas
?en una interaccion de tipo
llave-cerradura
? y que esta reaccion de acoplamiento era el desencadenante de la produccion de anticuerpos.
[
8
]
En 1904, siguiendo la idea de otros investigadores de que los anticuerpos se daban libres en la sangre,
Almroth Wright
sugirio que los anticuerpos solubles revestian las
bacterias
para senalarlas para su fagocitosis y destruccion en un proceso denominado
opsonizacion
.
[
9
]
En los anos 1920,
Michael Heidelberger
y
Oswald Avery
descubrieron la naturaleza de los postulados anticuerpos al observar que los antigenos podian ser precipitados por ellos y demostrando que estos eran un tipo de
proteinas
.
[
10
]
 Actual Universidad Rockefeller (antiguo Instituto), donde se desarrollaron buena parte de los avances en el estudio de los anticuerpos.
Actual Universidad Rockefeller (antiguo Instituto), donde se desarrollaron buena parte de los avances en el estudio de los anticuerpos.
A finales de los anos 1930
John Marrack
examino las propiedades bioquimicas de las uniones antigeno-anticuerpo.
[
11
]
Luego, en los anos 1940 tiene lugar el siguiente avance de importancia, cuando
Linus Pauling
confirmo la teoria de la llave y la cerradura propuesta por Ehrlich mostrando que las interacciones entre anticuerpos y antigenos dependian mas de su forma que de su composicion quimica.
[
12
]
En 1948,
Astrid Fagreaus
descubrio que los linfocitos B en su forma de
celula plasmatica
eran responsables de la produccion de anticuerpos.
[
13
]
Los siguientes trabajos de investigacion se concentraron en la caracterizacion de la estructura molecular de los anticuerpos:
Formas de anticuerpos
[
editar
]
 Diagrama de cintas de la
estructura molecular
de una
Inmunoglobulina A
, un tipo de Ig secretable.
Diagrama de cintas de la
estructura molecular
de una
Inmunoglobulina A
, un tipo de Ig secretable.
Los
linfocitos B
activados se
diferencian
en
celulas plasmaticas
, cuyo papel es la produccion de anticuerpos solubles o bien en linfocitos B de memoria, que sobreviven en el organismo durante los anos siguientes para posibilitar que el sistema inmune recuerde el antigeno y responda mas rapido a futuras exposiciones al agente inmunogeno.
[
22
]
Los anticuerpos son, por tanto, un producto esencial del
sistema inmunitario adaptativo
que aprenden y recuerdan las respuestas a patogenos invasores. Los anticuerpos se encuentran en dos formas: en forma
soluble
secretada
en la sangre y otros fluidos del cuerpo y en forma unida a la
membrana celular
que esta anclada a la superficie de un linfocito B.
Forma soluble
[
editar
]
Los anticuerpos solubles son secretados por un linfocito B activado (en su forma de
celula plasmatica
) para unirse a sustancias extranas y senalizarlas para su destruccion por el resto del sistema inmune. Tambien se les podria llamar
anticuerpos libres
hasta que se unen a un antigeno y acaban como parte de un
complejo antigeno-anticuerpo
o como
anticuerpos secretados
.
En estas formas solubles se unen a las inmunoglobulinas moleculas adicionales. En la IgM, por ejemplo, encontramos una glucoproteina unida a la Fraccion constante mediante puentes disulfuro de unos 15 K
D
llamada cadena J. Al isotipo IgA, ademas, se le une la llamada "pieza de secrecion". Se trata de una glucoproteina que se forma en las
celulas epiteliales
y
glandulas exocrinas
, y que posteriormente se une a la inmunoglobulina para facilitar su secrecion. (Pena, 1998)
Forma anclada a membrana
[
editar
]
La forma anclada a membrana de un anticuerpo se podria llamar
inmunoglobulina de superficie
(sIg) o
inmunoglobulina de membrana
(mIg), que no es secretado: siempre esta asociado a la
membrana celular
. Forma parte del
receptor del linfocito B
(BCR), que permite a este detectar cuando un antigeno especifico esta presente en el organismo, desencadenando la activacion del linfocito B.
[
23
]
El BCR se compone de anticuerpos IgD o IgM unidos a la superficie de membrana y sus heterodimeros asociados Ig-α e Ig-β que tienen capaz de producir la
transduccion de senal
del reconocimiento del anticuerpo a la celula.
[
24
]
Un linfocito B humano tipico tiene entre 50 000 y 100 000 anticuerpos unidos a su superficie.
[
24
]
Tras el acoplamiento del antigeno, estos se agrupan en grandes parches cuyo diametro puede exceder de 1 μm en
balsas lipidicas
que aislan los BCR (receptores de la celula B) de la mayor parte de los restantes receptores de
senalizacion celular
.
[
24
]
Estos parches podrian mejorar la eficiencia de la
respuesta inmune celular
.
[
25
]
En los seres humanos, la superficie celular esta libre de otras proteinas alrededor de los receptores de los linfocitos B en distancias de algunos miles de
angstroms
,
[
24
]
lo cual reduce de tal manera las influencias que compiten con su funcion, que incluso aisla a los BCR.
Isotipos, alotipos e idiotipos
[
editar
]
Tipos de anticuerpos en mamiferos
| Nombre
|
Tipos
|
Descripcion
|
Complejos de anticuerpos
|
| IgA
|
2
|
Se encuentra en las
mucosas
, como el
tubo digestivo
, el
tracto respiratorio
y el
tracto urogenital
. Impide su colonizacion por
patogenos
.
[
26
]
Tambien se encuentran en la
saliva
, las
lagrimas
y la
leche
.
|
|
| IgD
|
1
|
Su funcion consiste principalmente en servir de receptor de antigenos en los linfocitos B que no han sido expuestos a los antigenos.
[
27
]
Su funcion esta menos definida que en otros isotipos.
|
| IgE
|
1
|
Se une a
alergeno
y desencadena la liberacion de
histamina
de las
celulas cebadas
y
basofilos
y esta implicada en la
alergia
. Tambien protegen contra gusanos parasitos.
[
5
]
|
| IgG
|
4
|
Proporcionan, en sus cuatro formas, la mayor parte de la proteccion inmunitaria basada en anticuerpos contra los patogenos invasores.
[
5
]
Es el unico anticuerpo capaz de cruzar la
placenta
para proporcionar al feto inmunidad pasiva.
|
| IgM
|
1
|
Se expresa en la superficie de los linfocitos B y en forma de secrecion con gran avidez por su diana. Elimina los patogenos en los estadios tempranos de la respuesta inmune mediada por linfocitos B (humoral) hasta que existen suficientes IgGs.
[
5
]
[
27
]
|
Los anticuerpos pueden presentarse en distintas variedades conocidas como
isotipos
o clases. En
mamiferos placentados
existen cinco isotipos de anticuerpos conocidos como IgA, IgD, IgE, IgG e IgM. Se nombran mediante el prefijo "Ig" que significa inmunoglobulina y difieren en sus propiedades biologicas, localizaciones funcionales y capacidad para reconocer diferentes tipos de antigenos como se muestra en la tabla.
[
28
]
El isotipo cambia durante el desarrollo y la activacion de los linfocitos B. Antes de la maduracion de estos ultimos, cuando aun no se han expuesto a su antigeno, se conocen como linfocitos B virgenes y solo expresan el isotipo IgM en su forma anclada a la superficie celular. Los linfocitos comienzan a expresar tanto IgM como IgD cuando alcanzan la madurez y en ese momento estan listos para responder a su antigeno.
[
29
]
La activacion de los linfocitos B sigue al encuentro y union de este con su antigeno, lo que estimula a la celula para que se divide y se
diferencie
en una celula productora de anticuerpos denominada
plasmatica
. En esta forma activada, los linfocitos B comienzan a
secretar
anticuerpos en lugar de anclarlos a la membrana. Algunas celulas hijas de los linfocitos B activados sufren un
cambio isotipico
, un mecanismo que provoca que la produccion de anticuerpos en las formas IgM o IgD se trasmute a los otros tipos, IgE, IgA o IgG, que desempenan distintos papeles en el sistema inmunitario. Pero tambien existe un anticuerpo que neutraliza y inactiva a los virus se llama "
anticuerpo neutralizante
".
Alotipos
[
editar
]
Se entiende por alotipo las pequenas diferencias en la secuencia de
aminoacidos
en la region constante de las cadenas ligeras y pesadas de los anticuerpos producidos por los distintos individuos de una especie, que se heredan de forma
mendeliana
(Pena, 1998).
En seres humanos se han descrito 3 tipos de determinantes alotipicos:
- En 1956 Grubb y Laurell descubren el sistema Gm en la clase de inmunoglobulinas IgG. Este sistema puso de manifiesto los diversos alotipos de las cadenas pesadas. Tambien permite diferenciar cuatro subclases en estas moleculas: IgG1, IgG2, IgG3 e IgG4 y son determinados geneticamente.
[
30
]
- C. Ropartz
y colaboradores descubrieron en 1961 el sistema km (llamado Inv al principio), localizado en la cadena ligera Kappa. Este alotipo esta presente en todas las clases de inmunoglobulina.
- Tambien existe el sistema ISf, situado en la cadena pesada γ1 de la IgG1. La expresion de esta especificidad aumenta con la edad, siendo de un 25 % de los sujetos antes de los 20 anos hasta un 60 % despues de los 70 anos en los
caucasoides
.
- Los alotipos definidos por el sistema Am se situan en las IgA, y mas precisamente en las cadenas α2. Existen dos isotipos, α1 y α2, que caracterizan las subclases Am1 y Am2 de las IgA. (Staff, 2003).
Idiotipo
[
editar
]
El idiotipo es el
epitopo
propio de una molecula perteneciente a un clon en particular. Este elemento forma parte o esta muy proximo al lugar de reconocimiento del antigeno, y esta situado en la porcion variable Fab. En otras palabras, es el paratopo, o la region cercana de una inmunoglobulina puede ser reconocido como un epitopo por ciertos linfocitos (Staff, 2003). Segun la Teoria de
Jerne
, La formacion de anticuerpos antiidiotipo formaria una red (red de Jerne) cuya funcion seria la regulacion de la
sintesis
de nuevas inmunoglobulinas. (Pena, 1998).
Estructura
[
editar
]
Los anticuerpos son
proteinas
plasmaticas
globulares
pesadas (~150 k
Da
), tambien conocidas como inmunoglobulinas. Tienen cadenas de azucares unidas a alguno de sus residuos
aminoacido
.
[
31
]
En otras palabras, los anticuerpos son glucoproteinas. La unidad basica funcional de cada anticuerpo es el
monomero
de inmunoglobulina, que contiene una sola unidad de Ig. Los anticuerpos secretados tambien pueden ser
dimericos
con dos unidades Ig, como en el caso de las IgA, tetramericos con cuatro unidades Ig como en el caso de las IgM de
teleosteo
, o pentamericos con cinco unidades de IgM, como en el caso de las IgM de mamiferos.
[
32
]
 Las inmunoglobulinas constan de distintos dominios, que a su vez se agrupan en las dos cadenas pesadas (rojo y azul) y las dos cadenas ligeras (verde y amarillo) del anticuerpo. Los dominios de la inmunoglobulina estan compuestos de entre 7 (en el caso de la IgC) y 9 (IgV) plegamientos β.
[
33
]
Las inmunoglobulinas constan de distintos dominios, que a su vez se agrupan en las dos cadenas pesadas (rojo y azul) y las dos cadenas ligeras (verde y amarillo) del anticuerpo. Los dominios de la inmunoglobulina estan compuestos de entre 7 (en el caso de la IgC) y 9 (IgV) plegamientos β.
[
33
]
Primeros trabajos
[
editar
]
Las primeras investigaciones sobre la estructura de los anticuerpos fueron realizados mediante sencillas
digestiones
con
pepsina
y
papaina
por
Rodney Robert Porter
y
Gerald M. Edelman
, seguidas de
electroforesis
. Ambos recibieron por ello el
Premio Nobel
de medicina en 1972. Tambien fue importante la figura de
Alfred Nisonoff
:
- En los anos 1950, Porter procede a hacer una digestion suave con papaina, obteniendo tres fragmentos, dos de los cuales retenian la especificidad de antigeno (
Fab
), mientras que el tercero no mostraba actividad de union, mientras que se podia
cristalizar
(
Fc
).
- En 1959, Edelman, utilizando 2-
Mercaptoetanol
y
urea
, seguido de electroforesis, consigue aislar las cadenas ligeras y pesadas, al disociar sus
enlaces disulfuro
y no covalentes.
- Ese mismo ano, Porter identifica los componentes de las cadenas ligeras y pesadas que se encontraban en sus fragmentos de papaina y pepsina, y consigue sus
pesos moleculares
.
- En 1960, Nisonoff demostro que la digestion con pepsina de IgG producia un fragmento bivalente, que en realidad esta formado por otros dos, que el denomino
F (ab')
2
.
[
34
]
Dominios de inmunoglobulina
[
editar
]
El monomero de Ig es una molecula en forma de "Y" que consta de dos cadenas de
polipeptido
; dos
cadenas pesadas
identicas y dos
cadenas ligeras
identicas conectadas por enlaces disulfuro.
[
28
]
Cada cadena se compone de
dominios estructurales
llamados dominios Ig. Estos dominios contienen entre 70 y 110
aminoacidos
y se clasifican en diferentes categorias, por ejemplo en variables (IgV) y constantes (IgC) de acuerdo con su tamano y funcion.
[
35
]
Tienen un "pliegue inmunoglobulina" caracteristico en el cual dos
laminas beta
generan una forma de "sandwich", permaneciendo juntas por interacciones entre
cisteinas
bien conservadas a lo largo de la evolucion, asi como otros aminoacidos cargados.
Cadena pesada
[
editar
]
 1.
Region Fab
1.
Region Fab
2.
Region Fc
3.
Cadena pesada
con un dominio variable (V
H
) seguido por un dominio constante (C
H
1), una region bisagra, y dos mas constantes, los dominios (C
H
2 y C
H
3).
4.
Cadena ligera
con un dominio variable (V
L
) y uno constante (C
L
)
5. Lugar de union al antigeno (paratopo)
6. Regiones bisagra.
Hay cinco tipos de Ig en mamiferos que se nombran por letras griegas: α, δ, ε, γ y μ.
[
3
]
El tipo de cadena pesada presente define la
clase
(
isotipo
) del anticuerpo. Estas cadenas se encuentran en los anticuerpos IgA, IgD, IgE, IgG, e IgM respectivamente. Las distintas cadenas pesadas difieren en tamano y composicion: α y γ contienen aproximadamente 450 aminoacidos, mientras que μ y ε poseen aproximadamente 550
aminoacidos
.
[
3
]
Las cadenas pesadas γ, α y δ tienen una region constante compuesta de
tres
dominios estructurales Ig en
tandem
y una region bisagra para proporcionarle flexibilidad.
[
28
]
Las cadenas pesadas μ y ε tienen una region constante compuesta por
cuatro
dominios inmunoglobulina.
[
3
]
La region variable de la cadena pesada difiere en los anticuerpos producidos en los diferentes linfocitos B, pero es identica para todos los anticuerpos producidos por el mismo linfocito B o por su linea clonal. La region variable de cada cadena pesada es de aproximadamente 110 aminoacidos y esta compuesto por un unico dominio Ig.
Recientemente se ha podido determinar la
topologia
in vivo
del gen de la cadena pesada,
Igh
, siendo este uno de los primeros estudios en este campo. El resultado es que la cromatina se dispone formando giros sucesivos unidos por "linkers", dando lugar a formas similares a una flor. La posicion relativa de los distintos segmentos varia drasticamente a lo largo del desarrollo del
linfocito B
, permitiendo asi un mayor rango de interacciones genomicas.
[
36
]
Cadena ligera
[
editar
]
En los mamiferos hay dos tipos de
cadena ligera
, llamados lambda (λ) y kappa (κ).
[
3
]
Una cadena ligera contiene dos dominios sucesivos: un dominio constante y un dominio variable. La longitud aproximada de la cadena ligera es de 211 a 217 aminoacidos.
[
3
]
Cada anticuerpo contiene dos cadenas ligeras que son siempre identicas. Solo un tipo de cadena ligera, κ o λ, esta presente dentro del mismo anticuerpo en mamiferos. Otros tipos de cadenas ligeras como la cadena iota (ι), se encuentran en los
vertebrados
inferiores como los
condrictios
y
teleosteos
.
Regiones Fab y Fc
[
editar
]
 Inmunoglobulina: Region Fab fragmento de union al antigeno,
Inmunoglobulina: Region Fab fragmento de union al antigeno,
Region Fc: fragmento de union a la celula inmunitaria.
Region Fab
[
editar
]
Algunas partes del anticuerpo tienen funciones unicas. Los "extremos de la Y", por ejemplo, contienen el lugar que se une al antigeno y por tanto, reconoce elementos extranos especificos. Esta region del anticuerpo se llama
fragmento de union al antigeno
o region Fab. Esta compuesta de un dominio constante y otro variable de cada una de las cadenas ligera y pesada del anticuerpo.
[
37
]
El paratopo esta conformado por los dominios variables de la cadena pesada y ligera en el extremo amino terminal del monomero de anticuerpo.
Region Fc
[
editar
]
El papel que desempena el sector de "la base de la Y", consiste en modular la actividad de la celula inmunitaria. Esta region se llama Fc (de
fragmento cristalizable
) y esta compuesta por dos o tres dominios constantes de ambas cadenas pesadas, dependiendo de la clase del anticuerpo.
[
3
]
Mediante la union a proteinas especificas la region Fc se asegura que cada anticuerpo genera una respuesta inmune apropiada para un antigeno dado.
[
38
]
La region Fc tambien se une a varios
receptores celulares
como el
receptor del Fc
y otras moleculas del sistema inmunitario como las proteinas del
complemento
. Al efectuar esto, media en diferentes efectos
fisiologicos
incluyendo la
opsonizacion
,
lisis
celular y desgranulacion de las
celulas cebadas
,
basofilos
y
eosinofilos
.
[
28
]
[
39
]
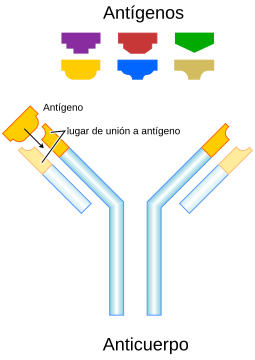 Cada anticuerpo se une a un antigeno especifico de forma similar a una llave en una cerradura.
Cada anticuerpo se une a un antigeno especifico de forma similar a una llave en una cerradura.
Puesto que los anticuerpos se dan de forma libre en el torrente sanguineo, se dice que son parte del
sistema inmunitario humoral
. Los anticuerpos circulantes son producidos por lineas clonales de linfocitos B que responden especificamente a un
antigeno
que puede ser un fragmento de proteina de la
capside
viral, por ejemplo. Los anticuerpos contribuyen a la inmunidad de tres formas distintas: pueden impedir que los patogenos entren en las celulas o las danen al unirse a ellas (neutralizacion). Pueden estimular la eliminacion de un patogeno por los
macrofagos
y otras celulas revistiendo al patogeno (opsonizacion) y pueden desencadenar la destruccion directa del patogeno estimulando otras
respuestas inmunes
como la via del complemento (lisis).
[
40
]
Activacion del complemento
[
editar
]
Los anticuerpos que se unen a la superficie de los antigenos, por ejemplo, en una
bacteria
, atraen los primeros componentes de la
cascada del complemento
mediante su region Fc e inician la activacion del sistema "clasico" del complemento.
[
40
]
Esto acaba con la muerte de la bacteria de dos formas:
[
5
]
Primero, la union de las moleculas del complemento con el anticuerpo marca al microbio para la ingestion por los
fagocitos
en un proceso llamado
opsonizacion
. Estos fagocitos son atraidos por ciertas moleculas del complemento. En segundo lugar, algunos componentes del
sistema del complemento
forman un
complejo de ataque a membrana
para ayudar a los anticuerpos a matar a la bacteria por medio de lisis. Los anticuerpos mas efectivos en la activacion del Sistema del Complemento son los de tipo IgM y los de tipo IgG subclase 1 y 3 (IgG1 e IgG3).
[
41
]
Activacion de celulas efectoras
[
editar
]
Para combatir a los patogenos que se replican en el exterior de las celulas, los anticuerpos se unen a los patogenos para ensamblarlos juntos provocando su
aglutinacion
. Puesto que un anticuerpo tiene al menos dos
paratopos
se puede unir a mas de un antigeno acoplandose a epitopos identicos portados en las superficies de esos antigenos. Revistiendo al patogeno, los anticuerpos estimulan las funciones efectoras contra este en las celulas que reconocen la region Fc.
[
5
]
Aquellas celulas que reconocen los patogenos revestidos tienen receptores del Fc que, como su nombre indica, interactuan con la region Fc de los anticuerpos IgA, IgG, e IgE. El acoplamiento de un anticuerpo particular con el receptor Fc de una determinada celula desencadena en ella una funcion efectora: los fagocitos realizaran la
fagocitosis
, las
celulas cebadas
y los
neutrofilos
produciran la degranulacion, las
celulas asesinas naturales
liberaran
citoquinas
y moleculas
citotoxicas
que finalmente acabaran con la destruccion del microbio invasor. Los receptores Fc son especificos del isotipo, lo que da una mayor flexibilidad al sistema inmune, afectando solo al mecanismo inmune adecuado para los distintos patogenos.
[
3
]
 Las
IgM
secretadas de
mamiferos
tienen cinco unidades Ig. Cada una de ellas (con el numero 1) tiene dos regiones Fab de union al
epitopo
, de modo que cada IgM se puede unir hasta a 10 epitopos.
Las
IgM
secretadas de
mamiferos
tienen cinco unidades Ig. Cada una de ellas (con el numero 1) tiene dos regiones Fab de union al
epitopo
, de modo que cada IgM se puede unir hasta a 10 epitopos.
Diversidad de las inmunoglobulinas
[
editar
]
Practicamente todos los microorganismos pueden desencadenar la respuesta de los anticuerpos. El reconocimiento y la erradicacion con exito de tipos muy distintos de estos ultimos requiere que los anticuerpos posean una enorme diversidad. Su composicion de aminoacidos varia para permitirles interactuar con antigenos muy diferentes.
[
42
]
Se ha estimado que los seres humanos generan unos 10 000 millones de anticuerpos diferentes, cada uno de ellos capaz de unirse a un epitopo distinto.
[
43
]
Aunque se genera un enorme repertorio de diferentes anticuerpos en un mismo individuo, el numero de
genes
disponible para fabricar estas proteinas es limitado. En los vertebrados han evolucionado diferentes mecanismos geneticos complejos para permitir que los linfocitos B generen esta diversidad a partir de un numero relativamente pequeno de genes de anticuerpos.
[
44
]
Variabilidad de dominios
[
editar
]
 Se muestran en rojo las regiones hipervariables de la cadena pesada, PDB 1IGT.
Se muestran en rojo las regiones hipervariables de la cadena pesada, PDB 1IGT.
La region (
locus
) del
cromosoma
que codifica un anticuerpo es grande y contiene varios
genes
diferentes para cada dominio del anticuerpo ?el locus que contiene los genes para las cadenas pesadas(
IGH@
) se encuentra en humanos en el
cromosoma 14
y los loci que contienen los genes lambda y kappa de la cadena ligera (
IGL@
e
IGK@
) se encuentran en los cromosomas
22
y
2
?. Uno de estos dominios es conocido como "dominio variable", que esta presente en todas las cadenas ligeras y pesadas de los anticuerpos, pero pueden ser diferentes entre los distintos anticuerpos generados por las variadas lineas de linfocitos B. Las diferencias entre los dominios variables se localizan en tres bucles conocidos como regiones hipervariables (HV-1, HV-2 y HV-3) o
regiones determinantes de la complementariedad
(CDR1, CDR2 y CDR3). Las CDRs se mantienen entre los dominios variables por regiones de marco conservado. El locus de la cadena pesada contiene unos 65 genes de dominio variable distintos, que difieren en sus CDRs. Combinando estos genes con varios genes de otros dominios se genera un gran contingente de anticuerpos con un alto grado de variabilidad. A esta combinacion se la denomina "recombinacion V (D) J, que explicamos a continuacion.
[
45
]
Recombinacion V (D) J
[
editar
]
 Esquema sencillo de la recombinacion V (D) J de las cadenas pesadas de inmunoglobulina.
Esquema sencillo de la recombinacion V (D) J de las cadenas pesadas de inmunoglobulina.
La
recombinacion somatica
de las inmunoglobulinas, conocida tambien como
Recombinacion V (D) J
, consiste en la generacion de una region variable de inmunoglobulina exclusiva. La region variable de cada inmunoglobulina pesada esta codificada por varias partes, que se conocen como segmentos. Estos son conocidos como segmento variable (V), diversidad (D) y de acoplamiento ?
joining
, en ingles? (J).
[
44
]
Los segmentos V, D y J se encuentran en las cadenas pesadas. En las ligeras solo encontramos los segmentos V y J. Hay multiples copias de todos estos segmentos organizadas en
tandem
en el
genoma
de los mamiferos. En la
medula osea
cada linfocito B en desarrollo ensambla la region variable de su inmunoglobulina seleccionando y combinando al azar un segmento V con uno D y otro J (o bien uno V y otro J en la cadena ligera). Puesto que existen multiples copias ligeramente distintas para cada
secuencia genetica
de los segmentos, se darian diferentes combinaciones que mediante este proceso generan un elevado numero de
paratopos
y tambien diferentes especificidades de antigeno.
[
2
]
Tras la produccion de una inmunoglobulina funcional por un linfocito B durante la recombinacion V(D)J no podra expresar ninguna region variable diferente (a este proceso se le conoce como
exclusion alelica
). Asi pues, cada linfocito B solo puede producir anticuerpos que contienen un solo tipo de cadena variable.
[
3
]
[
46
]
Hipermutacion somatica y maduracion de la afinidad
[
editar
]
Otro mecanismo que genera diversidad en los anticuerpos tiene lugar en los linfocitos B maduros. Tras la activacion por antigeno, los linfocitos B comienzan a
proliferar
rapidamente. En estas celulas en rapida division, los genes que codifican los dominios variables de las cadenas pesadas y ligeras sufren una gran tasa de
mutacion puntual
mediante un proceso llamado
hipermutacion somatica
(SHM). Esta produce aproximadamente el cambio de un
nucleotido
por gen variable y celula en cada division celular.
[
4
]
Como consecuencia, cualquier celula hija de una linea de linfocitos B adquiere una ligera diferencia en la secuencia de aminoacidos de los dominios variables de sus cadenas de anticuerpos.
La hipermutacion somatica sirve para incrementar la diversidad del reservorio de anticuerpos e influye en la
afinidad
de la union entre el antigeno y el anticuerpo.
[
47
]
Algunas mutaciones puntuales terminaran por producir anticuerpos que tienen interacciones mas debiles (baja afinidad) con su antigeno que el anticuerpo original, mientras que otras generaran anticuerpos con una interaccion mas fuerte (alta afinidad).
[
48
]
Los linfocitos B que expresan anticuerpos de elevada afinidad en su superficie recibiran una fuerte senal para que sobrevivan durante las interacciones con otras celulas, mientras que las que expresan anticuerpos de baja afinidad moriran por
apoptosis
.
[
48
]
Asi pues, los linfocitos B que expresan anticuerpos con una afinidad mas elevada por su antigeno competiran con ventaja contra aquellos de menor afinidad en su funcion y supervivencia. El proceso de generacion de anticuerpos con afinidad aumentada progresivamente se llama
maduracion de la afinidad
. La maduracion de la afinidad tiene lugar en los linfocitos B maduros tras la recombinacion V(D)J y es dependiente del soporte que reciban de los
linfocitos T colaboradores
.
[
49
]
 Mecanismo de recombinacion en el cambio de clase que permite el cambio de isotipo en los linfocitos B activados.
Mecanismo de recombinacion en el cambio de clase que permite el cambio de isotipo en los linfocitos B activados.
Cambio de clase
[
editar
]
La
Conmutacion de la clase de la inmunoglobulina
es un proceso biologico que tiene lugar tras la activacion de los linfocitos B, lo cual le permite la produccion de diferentes clases de anticuerpos (IgA, IgE, o IgG).
[
2
]
Estas clases estan definidas por las regiones constantes (C) de la cadena pesada de la inmunoglobulina. Inicialmente, los linfocitos B virgenes expresan solo IgM e IgD de superficie con regiones de union al anticuerpo identicas. Cada isotipo esta adaptado para una funcion distinta y, por tanto, tras la activacion, se necesita un anticuerpo con un efector IgG, IgA o IgE para la eliminacion eficaz del antigeno. La conmutacion de clase permite a la progenie de un solo linfocito B producir anticuerpos de diferentes isotipos. Solo la region constante de la cadena pesada del anticuerpo cambia durante la conmutacion de clase. Las regiones variables, y por tanto, la especificidad de antigeno, permanece invariable. De ese modo se producen efectores con la funcion adecuada para cada amenaza del antigeno. La conmutacion de clase se inicia por
citoquinas
. El isotipo generado depende de que citoquinas esten presentes en el entorno del linfocito B.
[
50
]
El proceso tiene lugar en el gen de la cadena pesada por un mecanismo conocido como recombinacion de conmutacion de clase ("class switch recombination" o CSR). Este mecanismo se basa en secuencias de nucleotidos conservadas, llamadas regiones de conmutacion
(Regiones switch o S)
, que se encuentran en un punto de la secuencia de
ADN
anterior a los genes de la region constante (excepto en la cadena δ). La hebra de
ADN
se escinde por la actividad de ciertas
enzimas
en dos regiones S concretas.
[
51
]
[
52
]
El
exon
del dominio variable se vuelve a empalmar mediante un proceso llamado
union de extremos no homologa
("non-homologous end joining" o NHEJ) a la region constante elegida (γ, α o ε). Este proceso concluye formando un gen de inmunoglobulina que codifica un anticuerpo de un isotipo diferente.
[
53
]
Conversion genica
[
editar
]
La conversion genica es un intercambio no reciproco, en el que la
secuencia
donante no se modifica, mientras que el
gen
aceptor adquiere un segmento del donante por recombinacion homologa. Aunque este mecanismo para generar diversidad en los anticuerpos se conocia, no se le habia dado la suficiente relevancia hasta ahora. Se sabe que es muy importante en
aves
, las cuales usan en sus cadenas ligeras y pesadas un gran numero de
pseudogenes
semejantes a las secuencias D, situadas al principio de la secuencia del gen de las cadenas de inmunoglobulina. Posteriormente, estos segmentos cambian
somaticamente
la unica region V, pudiendo tambien estar sometidas a
hipermutacion
.
[
54
]
Este mecanismo, curiosamente, tambien esta presente en algunos
mamiferos
, como los
conejos
.
[
55
]
Fases finales de la sintesis de inmunoglobulinas
[
editar
]
Una vez reagrupados todos los segmentos, se produce un solo
mARN
, que se
poliadenila
. Este ARN abandona el
nucleo
, dirigiendose a los
ribosomas
del
reticulo endoplasmico rugoso
, donde comienza su
traduccion
. Posteriormente se produce la
glicosilacion
de los mismos en la parte luminal del RER y el ensamblaje, cuyo proceso es el siguiente H+H → H2+L → H2L2. Constituye una excepcion la IgM, uniendose primero una cadena pesada con una ligera. Su destino final, como
receptor
o bien ser
secretada
, depende de si posee o no un fragmento anadido de 19
aminoacidos
en la zona
C-terminal
. Este
peptido
se incorpora a la sintesis mediante un proceso de
splicing
. Su presencia determina una region
hidrofobica
capaz de anclarse a la
membrana celular
(Pena, 1998).
Evolucion de las inmunoglobulinas
[
editar
]
El desarrollo de organismos complejos, con
tejidos
y varias lineas celulares necesito del desarrollo de nuevas moleculas para asegurar, por un lado, que las celulas se adherian a otras de la misma colonia y por otro, la defensa ante posibles intrusos
parasitos
o
patogenos
. Tres tipos de moleculas, las
lectinas
, las
LLR
y las
inmunoglobulinas
, han sido utilizadas a lo largo de la evolucion en el desarrollo de sistemas inmunitarios. Sus patrones operativos se mezclan en ocasiones para combinar sus propiedades, aunque existen pocas moleculas que contengan los tres, como es el caso del gen de la
enfermedad poliquistica renal
(PKD1).
[
56
]
Muchos estudios aportan pruebas importantes de que la
superfamilia de las inmunoglobulinas
tienen representantes entre las
bacterias
y
arqueas
o que al menos las presentes en este grupo y las de
eucariotas
podrian tener un antepasado comun, desde el cual evolucionaron de forma divergente. Asi, se han atribuido a este grupo de proteinas "semejantes a inmunoglobulina" bacterianas (BIg's) al receptor de la Fc de Ig en
Streptococcus agalactiae
, y la
endoglucanasa C
de
Cellumonas fimi
.
[
57
]
Tambien existen otros ejemplos como la
invasina
de
Yersinia pseudotuberculosis
o las Lig (
Leptospiral Ig-like
) de diversas especies de
Leptospira
.
[
58
]
[
59
]
Tras el hallazgo en
Streptococcus
se descubrio una proteina de este tipo en el
fago T4
. En esta ocasion se destaco que su papel estaba relacionado con la adhesividad celular.
[
60
]
Las proteinas con dominios Ig son comunes en
eucariotas
unicelulares, y hasta cierto punto su estructura es un rasgo conservado.
[
61
]
Un ejemplo de ello seria las alfa aglutininas en
Saccharomyces cerevisiae
. Se trata de moleculas que median la adhesion celular y que guardan grandes homologias con el grupo
CD2
-
CD4
en
humanos
, cuyo papel es en parte similar, interviniendo en este ultimo caso la adhesion de los
linfocitos T
con las celulas presentadoras de antigenos y las celulas diana.
[
62
]
 Intermediarios postulados en la evolucion molecular de los loci de las Ig y Los
TCR
. Para una explicacion detallada ver nota.
[
63
]
Intermediarios postulados en la evolucion molecular de los loci de las Ig y Los
TCR
. Para una explicacion detallada ver nota.
[
63
]
Animales pluricelulares
[
editar
]
Sin embargo, es en los grupos de animales pluricelulares mas primitivos, los
parazoa
, donde los cientificos intentan hallar respuestas al origen del sistema inmunitario adaptativo.
[
64
]
En este sentido, se han dirigido varios trabajos de investigacion hacia este grupo, y en especial hacia una
esponja
considerada como fosil viviente,
Geodia cydonium
y tambien
Suberites domuncula
. En esta primera se encuentran muchos de los tipos de proteinas que tambien estan implicadas en la inmunidad de
mamiferos
. En especial, hay dos tipos de la superfamilia de las inmunoglobulinas distintas, las unidas a
receptor tirosin kinasa
, y las moleculas no enzimaticas de adhesion de las esponjas. Curiosamente, los dominios correspondientes ya demuestran polimorfismo, y aun mas, aunque cumplen papeles que son simultaneamente de receptores, y de moleculas de
adherencia celular
, se sobreregulan en experimentos de
injerto
.
[
65
]
En definitiva, la
superfamilia de las inmunoglobulinas
intervino en el surgimiento de la multicelularidad al mantener la integridad estructural de los organismos distinguiendo de lo propio de lo ajeno. Esto se debe a que gracias a sus capacidades de generar modulos, de unirse especificamente a otras
proteinas
y de formar bastones, asi como de oligomerizarse y generar diversidad por
splicing alternativo
a partir de material genetico limitado, se convierten en ideales para mediar la adherencia celular y como receptores de superficie de membrana.
[
66
]
[
67
]
En la busqueda de precedentes del
sistema inmunitario
adaptativo, encontramos varios ejemplos de proteinas de la superfamilia de las Ig en
protostomos
que cumplen un papel en la defensa inmunitaria, como la
hemolina
en
gusanos de seda
, o la proteina
Dscam
en
Drosophila melanogaster
, asi como proteinas relacionadas con el fibrinogeno con dominios Ig (FREP) en
gasteropodos
. Algunas de estas proteinas, que representan una barrera de tipo innato, pueden tener isoformas solubles y ancladas a membrana, y generar diversidad por
splicing alternativo
, y en zonas de la molecula diferentes a las cadenas variables de vertebrados.
[
68
]
Deuterostomos
[
editar
]
Muchos de los elementos del sistema inmune adaptativo, incluidas las celulas especializadas, estan ya preconfigurados en los organismos mas basales de los
deuterostomos
. Se han realizado trabajos en el erizo de mar
Strongylocentrotus purpuratus
, encontrandose un rico
sistema inmunitario
con homologos de importantes reguladores inmunitarios y
hematopoyeticos
de
vertebrados
, algunos de ellos criticos. Se especula por ello que la
presion evolutiva
clave para el desarrollo del complejo sistema inmunitario en deuterostomos no fue tanto la amenaza de patogenos como la existencia de una rica variedad de organismos
simbiontes
, circunstancia que los propios seres humanos ponemos en evidencia en nuestra
flora intestinal
.
[
69
]
Como ilustracion de este punto, se ha visto que el 60 % de las especies de
equinodermos
se asocian con simbiontes bacterianos.
[
70
]
En
tunicados
continua el aumento de la complejidad del sistema inmune. En la ascidia
Botryllus schlosseri
, durante experimentos de injertos no compatibles, se detectaron muchas proteinas que revelan un complejo sistema inmune innato y algunas proteinas con dominio inmunoglobulina.
[
71
]
[
72
]
Y lo que resulta mas sorprendente, tambien se puede encontrar un homologo convincente de
RAG1
, contiguo a una estructura similar a RAG2. Posteriormente expondremos la importancia de esto ultimo.
[
73
]
Sin embargo, es en
cefalocordados
donde encontramos las primeras huellas de nuestras actuales inmunoglobulinas. Se han realizado multiples estudios en el anfioxo
Branchiostoma floridae
, encontrando unas curiosas proteinas, llamadas VCBP (por Proteinas tipo V que contienen dominios que se unen a
quitina
) con grandes homologias con las regiones V (variables) de las inmunoglobulinas, ciertamente implicadas en la respuesta inmunitaria, pero carentes de su variabilidad. Estudios
cristalograficos
han demostrado que probablemente se trata de una molecula semejante al ancestro de las actuales regiones variables de vertebrados.
[
74
]
[
75
]
[
76
]
En los actuales
agnatos
se dan alguno de los rasgos que identifican un moderno sistema inmunitario adaptativo, mientras que otros estan ausentes. Por una parte, existen celulas que ya contienen gran parte de la maquinaria molecular de los
linfocitos
. Esto sugiere una evolucion de este tipo celular en los
vertebrados
mas basales, y posiblemente en un
protocordado
. Existen varias proteinas Ig con dominios semejantes a V, que incluso contienen regiones V y J, aunque estan codificados en un unico
exon
y no es reorganizable. Sin embargo, no poseen un sistema inmunitario como el de los vertebrados, basado en los clasicos anticuerpos solubles, receptores de membrana, reorganizacion y empalme por RAG. En lugar de ello, esta funcion es asumida por una serie de proteinas ricas en
repeticiones de leucina
, que incluso pueden sufrir una compleja recombinacion, a resultas de la cual se obtiene una variabilidad equiparable a la de los anticuerpos (10
14
). Esto constituye un extraordinario ejemplo de evolucion paralela.
[
77
]
Gnatostomados
[
editar
]
Todos los autores revisados en este articulo coinciden en que la emergencia del moderno sistema inmunitario tuvo que suceder hace 500 millones de anos, durante la
explosion cambrica
. Probablemente lo harian dentro de un contexto en el que existirian muchas formas y combinaciones de modulos de proteinas de las que muchas desaparecerian por las presiones selectivas. En este sentido, una de las cuestiones que suscita el apartado anterior es que si la evidencia
paleontologica
indica que los
peces mandibulados
actuales proceden de los agnatos, y estos carecen del mismo sistema recombinacion de los modernos sistemas inmunitarios, Seguramente debio existir un antepasado comun, un
ostracodermo
ancestral que poseyera ambos sistemas. De acuerdo con este punto de vista, el sistema de
recombinacion V (D) J
probablemente representa un desarrollo evolutivo convergente en una rama de los ostracodermos que precedio a la linea de los gnatostomos.
[
78
]
En cuanto a las clases de las inmunoglobulinas, en
peces
encontramos analogos a la clase
IgM
, asi como la
IgD
, identificada en muchas especies de
teleosteos
.
[
79
]
Tambien existen muchas exclusivas, como las que contienen las cadenas pesadas ζ y τ. Posiblemente son isotipos anteriores a la IgM en la evolucion.
[
80
]
[
81
]
En el caso de los
condrictios
tambien encontramos isotipos exclusivos, ademas de IgM. Se trata de las IgW (IgX o IgNARC) y las IgNAR.
[
82
]
El tipo
IgG
surge en
anfibios
y continua en
reptiles
, mientras que el tipo
IgA
aparentemente surge en un antepasado comun entre
aves
y
mamiferos
. El tipo
IgE
parece ser exclusivo de mamiferos (Pena, 1998).
Aplicaciones medicas
[
editar
]
 Angel del Oeste
(
Angel of the West
) (2008) de
Julian Voss-Andreae
es una escultura basada en la estructura del anticuerpo publicada por E. Padlan.
[
83
]
Disenada para el campus Florida del Instituto de Investigacion Scripps,
[
84
]
el anticuerpo se ubica dentro de un anillo que recuerda al
Hombre de Vitruvio
de
Leonardo da Vinci
, destacando asi las proporciones similares del anticuerpo y del cuerpo humano.
[
85
]
Angel del Oeste
(
Angel of the West
) (2008) de
Julian Voss-Andreae
es una escultura basada en la estructura del anticuerpo publicada por E. Padlan.
[
83
]
Disenada para el campus Florida del Instituto de Investigacion Scripps,
[
84
]
el anticuerpo se ubica dentro de un anillo que recuerda al
Hombre de Vitruvio
de
Leonardo da Vinci
, destacando asi las proporciones similares del anticuerpo y del cuerpo humano.
[
85
]
Diagnostico de enfermedades
[
editar
]
En muchos
diagnosticos
es comun la deteccion de anticuerpos como prueba de confirmacion de la patologia. Para ello se realiza una
prueba serologica
.
[
86
]
Como ejemplos, en ensayos bioquimicos para el diagnostico de enfermedades, se estima el
titulo
de anticuerpos contra el
virus de Epstein-Barr
o contra la
enfermedad de Lyme
.
[
87
]
Si no se encuentran esos anticuerpos significa que la persona no esta infectada o que lo estuvo hace
mucho
tiempo y los linfocitos B que generaban estos anticuerpos se han reducido de forma natural.
En la inmunologia clinica se valora por
nefelometria
(o turbidimetria) los niveles de las distintas clases de inmunoglobulinas para caracterizar el perfil de anticuerpos del paciente.
[
88
]
Por ejemplo, una observacion en elevacion del titulo de las distintas clases de inmunoglobulina puede ser util en ocasiones para determinar la causa del dano
hepatico
mediante diagnostico diferencial. En este sentido, un titulo elevado de IgA indicaria
cirrosis
alcoholica; si lo que esta elevado son las IgM se sospecha de
hepatitis viral
y
cirrosis biliar primaria
, mientras que la IgG esta elevada en hepatitis virica, autoinmune y cirrosis.
Las
enfermedades autoinmunes
se puede diagnosticar por anticuerpos que se unen a
epitopos
del propio organismo; muchos de ellos se pueden detectar mediante
analisis de sangre
. Un ejemplo seria el caso de los anticuerpos dirigidos contra los antigenos de superficie de
eritrocitos
en la
anemia hemolitica
mediada por el sistema inmunitario, que se detectan mediante la
prueba de Coombs
.
[
89
]
Esta prueba tambien se usa para rastrear anticuerpos en la preparacion de
transfusiones de sangre
y tambien en las mujeres en el periodo
prenatal
.
[
89
]
En la practica existen muchos metodos inmunodiagnosticos basados en la deteccion de complejos antigeno-anticuerpo que se utilizan en el diagnostico de enfermedades infecciosas, por ejemplo
ELISA
,
inmunofluorescencia
,
Western blot
,
inmunodifusion
e
inmunoelectroforesis
.
Tratamientos terapeuticos
[
editar
]
La terapia de
anticuerpos monoclonales
se emplea en el tratamiento de enfermedades como la
artritis reumatoide
,
[
90
]
esclerosis multiple
,
[
91
]
psoriasis
,
[
92
]
y muchas formas de cancer, incluyendo el
linfoma no Hodgkin
,
[
93
]
cancer colorrectal
,
cancer de cabeza y cuello
y
cancer de mama
.
[
94
]
Algunas
inmunodeficiencias
, como la
agammaglobulinemia ligada al cromosoma X
y la
hipogammaglobulinemia
consisten en una carencia parcial o completa de anticuerpos.
[
95
]
Estas enfermedades se tratan a veces induciendo una inmunidad a corto plazo llamada
inmunidad pasiva
. Esta se adquiere a traves de la infusion de anticuerpos "prefabricados" en forma de
suero
humano o animal, inmunoglobulina intravenosa o anticuerpos monoclonales en el individuo afectado.
[
96
]
Terapia prenatal
[
editar
]
Las llamadas
Rho (D) Inmunoglobulinas
o inmunoglobulilas anti-RhD son especificos del antigeno humano Rhesus D tambien conocido como
factor Rhesus
.
[
97
]
De estos anticuerpos anti-RhD se conocen varias marcas comerciales, como RhoGAM, BayRHo-D, Gamulin Rh, HypRho-D, y WinRho SDF. El factor Rhesus es un
antigeno
que se encuentra en los
eritrocitos
. Los individuos Rhesus-positivo (Rh+) exhiben este anticuerpo en el
glucocalix
de sus eritrocitos, mientras que los individuos (Rh?) carecen de el.
Durante nacimiento normal, la sangre
fetal
puede pasar a la madre por traumas en el parto o complicaciones del embarazo. En el caso de
incompatibilidad Rh
entre la madre y el hijo, la consiguiente mezcla de sangre puede sensibilizar a una madre Rh- contra el antigeno Rh del hijo, haciendo que en los siguientes embarazos corran riesgo de
eritroblastosis fetal
.
[
98
]
Los anti-RhD se administran como parte del tratamiento prenatal para prevenir la sensibilizacion que pudiera tener lugar para evitarlo. Al tratar a la madre con anticuerpos anti-RhD antes e inmediatamente despues del trauma y el parto destruye el antigeno Rh del feto en el cuerpo de la madre. Un tema importante es que esto sucede antes de que el antigeno pueda estimular los linfocitos B maternos que mas tarde podrian "recordar" el antigeno Rh generando linfocitos B con memoria. Por tanto, su sistema humoral inmune no fabricara anticuerpos anti-Rh y no atacara los antigenos Rhesus de su bebe actual o futuro.
[
97
]
Aplicaciones en la investigacion cientifica
[
editar
]
 Imagen de
Inmunofluorescencia
del
citoesqueleto
de
eucariotas
. Los filamentos de
Actina
se muestran en rojo, los
microtubulos
en verde y el
nucleo celular
en azul.
Imagen de
Inmunofluorescencia
del
citoesqueleto
de
eucariotas
. Los filamentos de
Actina
se muestran en rojo, los
microtubulos
en verde y el
nucleo celular
en azul.
En investigacion, los anticuerpos purificados se usan en muchas aplicaciones. Son muy habituales para identificar y localizar proteinas intra y extracelulares. Los anticuerpos se usan en la
citometria de flujo
para diferenciar los tipos celulares por las proteinas que expresan; los diferentes tipos celulares expresan tambien diferentes combinaciones de moleculas del
cumulo de diferenciacion
(CD) en su superficie y producen diferentes proteinas intracelulares, extracelulares y excretables.
[
99
]
Tambien se usan en
inmunoprecipitacion
para separar las proteinas y cualquier cosa que este unida a ellas (co-inmunoprecipitacion) de otras moleculas en un
lisado de celulas
,
[
100
]
en analisis
Western blot
para identificar proteinas separadas por
electroforesis
,
[
101
]
y en
inmunohistoquimica
o
inmunofluorescencia
para examinar la expresion de proteinas en secciones de tejidos o localizar proteinas en el interior de las celulas con el auxilio de un
microscopio
.
[
99
]
[
102
]
Las proteinas tambien se pueden detectar y cuantificar con anticuerpos, utilizando tecnicas
ELISA
y
ELISPOT
.
[
103
]
[
104
]
Variantes de anticuerpos en medicina e investigacion
[
editar
]
En ocasiones se necesita producir anticuerpos especificos. Inyectando un
antigeno
en un
mamifero
, como
raton
,
rata
o
conejo
si se requiere poca cantidad;
Cabra
,
oveja
o
caballo
si se requiere grandes cantidades. La sangre aislada de estos animales contiene
anticuerpos policlonales
?multiples anticuerpos que se unen al mismo antigeno? en el suero sanguineo, al cual se denomina
antisuero
. Tambien se pueden inyectar antigenos en
gallinas
y recoger en la
yema de huevo
los anticuerpos policlonales IgY producidos.
[
105
]
Sin embargo, para aplicaciones analiticas es necesaria una mayor especificidad, sobre todo si se trata de detectar moleculas muy pequenas, asi como cuando se usan en aplicaciones terapeuticas en las que se desea bloquear o detectar marcadores muy especificos. Por ello la tecnologia de los anticuerpos ha generado algunas variantes, entre las que se destacan:
- Anticuerpos monoclonales
- Si se desea obtener anticuerpos especificos para un unico epitopo de un antigeno, se aislan linfocitos secretores de anticuerpos de un animal y se inmortalizan fusionandolos con una linea celular cancerosa. Las celulas fusionadas se denominan
hibridomas
y continuaran creciendo y secretando anticuerpo en el cultivo. Se aislan las celulas de hibridoma individuales mediante
clonado por dilucion
para generar
clones
que produzcan todos el mismo anticuerpo. A estos anticuerpos se les denomina
anticuerpos monoclonales
.
[
106
]
Los anticuerpos mono y policlonales generados se pueden purificar utilizando
proteina A/G
o
cromatografia de afinidad al antigeno
.
[
107
]
- Anticuerpos de cadena sencilla
- Es posible generar artificialmente un anticuerpo que cuente solo con las regiones variables de la cadena ligera y pesada, unidas por un pequeno
peptido
o un solo
aminoacido
. En este caso tendremos
anticuerpos de cadena sencilla
o scFv's. Actualmente se aplican en tecnicas como la
citometria de flujo
o la inmunohistoquimica.
[
108
]
- Abzimas
- La mayoria de los anticuerpos se diferencian de otras proteinas por no presentar catalisis
enzimatica
en su funcion, por lo que tradicionalmente se consideran proteinas de reconocimiento de superficies
moleculares
. Sin embargo, en la decada de los anos 90 del siglo
XX
y principios del siglo
XXI
diversos estudios de inmunologia encontraron anticuerpos con propiedades cataliticas. Dichos anticuerpos han recibido el nombre de abzimas. Es posible encontrarlas en cantidades bajas en el suero de personas sanas. Un ejemplo de la existencia de las abzimas en el cuerpo humano fue la deteccion de abzimas contra
ADN
en la leche materna.
[
109
]
Entre algunas otras de estas actividades cataliticas detectadas estan las de peptidasas inespecificas y amiloliticas (degradacion de almidon). Por otro lado se ha observado un incremento en el nivel de abzimas en enfermedades de tipo
autoinmune
. Sin embargo, normalmente se fabrican de forma artificial generando anticuerpos contra el compuesto intermediario de una reaccion para la que se desea crear una enzima. En algunas ocasiones podrian tener aplicaciones terapeuticas e industriales.
[
110
]
[
111
]
- Nanoanticuerpos
Existen propuestas para la utilizacion terapeutica de anticuerpos monoclonales de
camelido
, tambien llamados
nanoanticuerpos
. Estos son excepcionales en el reino animal, dado su reducido tamano, debido a que estan compuestos unicamente por dos cadenas pesadas.
[
112
]
Tales peculiaridades les permitirian acceder a localizaciones celulares y antigenos inaccesibles para los anticuerpos normales, ademas de ser posible su administracion oral.
[
113
]
- Faboterapicos
Para obtener
antidotos
contra
venenos
de picaduras por animales como
serpientes
o
artropodos
, se fabrican
antisueros
mediante suero crudo o bien altamente enriquecido en inmunoglobulinas. Estos procedimientos producian un gran numero de reacciones
alergicas
, como
anafilaxias
o la
enfermedad del suero
. Para evitarlo, en los anos 40 y 50 se realizaron estudios de
proteolisis
para reducir al minimo la parte de la molecula implicada en la neutralizacion del veneno. Finalmente se encontro que el fragmento F (ab’)2, resultante de la digestion con
pepsina
de los anticuerpos, que carece de las zonas efectoras de la molecula, puede neutralizar igualmente venenos. El profesor
Alejandro Alagon Cano
propuso para este enfoque terapeutico el nombre de
faboterapia
, observandose una incidencia mucho menor de reacciones adversas al suero, asi como un mejor alcance del compartimento
extravascular
.
[
114
]
Vease tambien
[
editar
]
Referencias
[
editar
]
- ↑
Litman, G. W., Rast, J. P., Shamblott, M. J.,
et al.
(1993).
≪Phylogenetic diversification of immunoglobulin genes and the antibody repertoire≫
.
Mol. Biol. Evol.
10
(1): 60-72.
PMID
8450761
.
- ↑
a
b
c
d
Market, Eleonora; Nina Papavasiliou (2003)
≪V(D)J Recombination and the Evolution of the Adaptive Immune System≫
PLoS Biology
1(1): e16.
doi
10.1371/journal.pbio.0000016
- ↑
a
b
c
d
e
f
g
h
i
Janeway, C. A., Jr
et al.
(2001).
Immunobiology.
(5th ed. edicion). Garland Publishing.
ISBN
0-8153-3642-X
.
- ↑
a
b
Diaz, M., Casali, P. (2002). ≪Somatic immunoglobulin hypermutation≫.
Curr Opin Immunol
14
(2): 235-40.
PMID
11869898
.
doi
:
10.1016/S0952-7915(02)00327-8
.
- ↑
a
b
c
d
e
f
Pier, G. B., Lyczak, J. B., Wetzler, L. M. (2004).
Immunology, Infection, and Immunity
. ASM Press.
ISBN
1-55581-246-5
.
- ↑
≪Emil von Behring - Biography≫
. Consultado el 5 de junio de 2007
.
- ↑
AGN (1931).
≪The Late Baron Shibasaburo Kitasato≫
.
Canadian Medical Association Journal
: 206.
- ↑
Winau, F., Westphal, O., Winau, R. (2004). ≪Paul Ehrlich--in search of the magic bullet≫.
Microbes Infect.
6
(8): 786-9.
PMID
15207826
.
doi
:
10.1016/j.micinf.2004.04.003
.
- ↑
Silverstein, A. M. (2003). ≪Cellular versus humoral immunology: a century-long dispute≫.
Nat. Immunol.
4
(5): 425-8.
PMID
12719732
.
doi
:
10.1038/ni0503-425
.
- ↑
Van Epps, H. L. (2006).
≪Michael Heidelberger and the demystification of antibodies≫
.
J. Exp. Med.
203
(1): 5.
PMID
16523537
.
doi
:
10.1084/jem.2031fta
.
- ↑
Marrack, J. R. (1938).
Chemistry of antigens and antibodies
(2nd ed. edicion). Londres: His Majesty's Stationery Office.
OCLC
3220539
.
- ↑
≪The Linus Pauling Papers: How Antibodies and Enzymes Work≫
. Consultado el 5 de junio de 2007
.
- ↑
Silverstein, A. M. (2004).
≪Labeled antigens and antibodies: the evolution of magic markers and magic bullets≫
.
Nat. Immunol.
5
(12): 1211-7.
PMID
15549122
.
doi
:
10.1038/ni1140
. Archivado desde
el original
el 16 de junio de 2007.
- ↑
Edelman, G. M., Gally, J. A. (1962). ≪The nature of Bence-Jones proteins. Chemical similarities to polypetide chains of myeloma globulins and normal gamma-globulins≫.
J. Exp. Med.
116
: 207-27.
PMID
13889153
.
- ↑
Stevens, F. J., Solomon, A., Schiffer, M. (1991). ≪Bence Jones proteins: a powerful tool for the fundamental study of protein chemistry and pathophysiology≫.
Biochemistry
30
(28): 6803-5.
PMID
2069946
.
doi
:
10.1021/bi00242a001
.
- ↑
a
b
Raju, T. N. (1999). ≪The Nobel chronicles. 1972: Gerald M Edelman (b 1929) and Rodney R Porter (1917-85)≫.
Lancet
354
(9183): 1040.
PMID
10501404
.
- ↑
Tomasi TB (1992). ≪The discovery of secretory IgA and the mucosal immune system≫.
Immunol. Today
13
(10): 416-8.
PMID
1343085
.
- ↑
Preud'homme, J. L., Petit, I., Barra, A., Morel, F., Lecron, J. C., Lelievre, E. (2000). ≪Structural and functional properties of membrane and secreted IgD≫.
Mol. Immunol.
37
(15): 871-87.
PMID
11282392
.
doi
:
10.1016/S0161-5890(01)00006-2
.
- ↑
Johansson, S. G. (2006). ≪The discovery of immunoglobulin E≫.
Allergy and asthma proceedings : the official journal of regional and state allergy societies
27
(2 Suppl 1): S3-6.
PMID
16722325
.
- ↑
Raju, T. N. (Jan. de 2000). ≪The Nobel chronicles. 1984: Niels Kai Jerne, (1911-94); Cesar Milstein (b 1926); and Georges Jean Franz Kohler (1946-95)≫.
The Lancet
355
(9197): 75.
PMID
10615922
.
doi
:
10.1016/S0140-6736(05)72025-0
.
- ↑
Hozumi, N., Tonegawa, S. (1976).
≪Evidence for somatic rearrangement of immunoglobulin genes coding for variable and constant regions≫
.
Proc. Natl. Acad. Sci. U.S.A.
73
(10): 3628-32.
PMID
824647
.
- ↑
Borghesi, L., Milcarek, C. (2006). ≪From B cell to plasma cell: regulation of V(D)J recombination and antibody secretion≫.
Immunol Res
36
(1-3): 27-32.
PMID
17337763
.
doi
:
10.1385/IR:36:1:27
.
- ↑
Parker, D. (1993). ≪T cell-dependent B cell activation≫.
Annu Rev Immunol
11
: 331-60.
PMID
8476565
.
doi
:
10.1146/annurev.iy.11.040193.001555
.
- ↑
a
b
c
d
Wintrobe, Maxwell Myer
(2004).
Wintrobe's clinical hematology
. John G. Greer, John Foerster, John N Lukens, George M Rodgers, Frixos Paraskevas (11 edicion). Hagerstwon, MD: Lippincott Williams & Wilkins. pp. 453-456.
ISBN
0-7817-3650-1
.
- ↑
Tolar, P., Sohn, H. W., Pierce, S. K. (February de 2008).
≪Viewing the antigen-induced initiation of B-cell activation in living cells≫
.
Immunol. Rev.
221
: 64-76.
PMID
18275475
.
doi
:
10.1111/j.1600-065X.2008.00583.x
.
- ↑
Underdown B, Schiff J (1986).
≪Immunoglobulin A: strategic defense initiative at the mucosal surface≫
.
Annu Rev Immunol
4
: 389-417.
PMID
3518747
.
doi
:
10.1146/annurev.iy.04.040186.002133
.
- ↑
a
b
Geisberger R, Lamers M, Achatz G (2006).
≪The riddle of the dual expression of IgM and IgD≫
.
Immunology
118
(4): 429-37.
PMID
16895553
.
- ↑
a
b
c
d
Woof, J., Burton, D. (2004). ≪Human antibody-Fc receptor interactions illuminated by crystal structures≫.
Nat Rev Immunol
4
(2): 89-99.
PMID
15040582
.
doi
:
10.1038/nri1266
.
- ↑
Goding, J. ≪Allotypes of IgM and IgD receptors in the mouse: a probe for lymphocyte differentiation≫.
Contemp Top Immunobiol
8
: 203-43.
PMID
357078
.
- ↑
Grubb, R., and Laurell, A. B., Acta Path. Microb. Scand., 39, 390 (1956).
PMID 13381487
- ↑
Mattu, T., Pleass, R., Willis, A., Kilian, M., Wormald, M., Lellouch, A., Rudd, P., Woof, J., Dwek, R. (1998). ≪The glycosylation and structure of human serum IgA1, Fab, and Fc regions and the role of N-glycosylation on Fc alpha receptor interactions≫.
J Biol Chem
273
(4): 2260-72.
PMID
9442070
.
doi
:
10.1074/jbc.273.4.2260
.
- ↑
Roux, K. (1999). ≪Immunoglobulin structure and function as revealed by electron microscopy≫.
Int Arch Allergy Immunol
120
(2): 85-99.
PMID
10545762
.
doi
:
10.1159/000024226
.
- ↑
≪Antigen binding sites≫
(en ingles)
. Archivado desde
el original
el 19 de abril de 2007.
- ↑
Stevenson, J. R. (18 de agosto).
≪Immunoglobulin Structure and Function≫
. CAS, Universidad de Miami. Archivado desde
el original
el 25 de septiembre de 2008
. Consultado el 25 de agosto de 2008
.
- ↑
Barclay, A. (2003). ≪Membrane proteins with immunoglobulin-like domains--a master superfamily of interaction molecules≫.
Semin Immunol
15
(4): 215-23.
PMID
14690046
.
doi
:
10.1016/S1044-5323(03)00047-2
.
- ↑
Murre, C. y otros: (2008). ≪The 3D structure of the immunoglobulin heavy-chain locus: implications for long-range genomic interactions≫.
Cell
133
(2).
PMID 18423198
.
- ↑
Putnam, F. W., Liu, Y. S., Low, T. L. (1979). ≪Primary structure of a human IgA1 immunoglobulin. IV. Streptococcal IgA1 protease, digestion, Fab and Fc fragments, and the complete amino acid sequence of the alpha 1 heavy chain≫.
J Biol Chem
254
(8): 2865-74.
PMID
107164
.
- ↑
Huber, R. (1980). ≪Spatial structure of immunoglobulin molecules≫.
Klin Wochenschr
58
(22): 1217-31.
PMID
6780722
.
doi
:
10.1007/BF01478928
.
- ↑
Heyman, B. (1996). ≪Complement and Fc-receptors in regulation of the antibody response≫.
Immunol Lett
54
(2-3): 195-9.
PMID
9052877
.
doi
:
10.1016/S0165-2478(96)02672-7
.
- ↑
a
b
Ravetch, J., Bolland, S. (2001). ≪IgG Fc receptors≫.
Annu Rev Immunol
19
: 275-90.
PMID
11244038
.
doi
:
10.1146/annurev.immunol.19.1.275
.
- ↑
Rus, H., Cudrici, C., Niculescu, F. (2005). ≪The role of the complement system in innate immunity≫.
Immunol Res
33
(2): 103-12.
PMID
16234578
.
doi
:
10.1385/IR:33:2:103
.
- ↑
Mian, I., Bradwell, A., Olson, A. (1991). ≪Structure, function and properties of antibody binding sites≫.
J Mol Biol
217
(1): 133-51.
PMID
1988675
.
doi
:
10.1016/0022-2836(91)90617-F
.
- ↑
Fanning, L. J., Connor, A. M., Wu, G. E. (1996). ≪Development of the immunoglobulin repertoire≫.
Clin. Immunol. Immunopathol.
79
(1): 1-14.
PMID
8612345
.
- ↑
a
b
Nemazee, D. (2006). ≪Receptor editing in lymphocyte development and central tolerance≫.
Nat Rev Immunol
6
(10): 728-40.
PMID
16998507
.
doi
:
10.1038/nri1939
.
- ↑
Peter Parham. "The Immune System. 2nd ed. Garland Science: New York, 2005. pg.47-62
- ↑
Bergman, Y., Cedar, H. (2004). ≪A stepwise epigenetic process controls immunoglobulin allelic exclusion≫.
Nat Rev Immunol
4
(10): 753-61.
PMID
15459667
.
doi
:
10.1038/nri1458
.
- ↑
Honjo, T., Habu, S. (1985).
≪Origin of immune diversity: genetic variation and selection≫
.
Annu Rev Biochem
54
: 803-30.
PMID
3927822
.
doi
:
10.1146/annurev.bi.54.070185.004103
.
- ↑
a
b
Or-Guil, M., Wittenbrink, N., Weiser, A. A., Schuchhardt, J. (2007). ≪Recirculation of germinal center B cells: a multilevel selection strategy for antibody maturation≫.
Immunol. Rev.
216
: 130-41.
PMID
17367339
.
doi
:
10.1111/j.1600-065X.2007.00507.x
.
- ↑
Neuberger, M., Ehrenstein, M., Rada, C., Sale, J., Batista, F., Williams, G., Milstein, C. (2000).
≪Memory in the B-cell compartment: antibody affinity maturation≫
.
Philos Trans R Soc Lond B Biol Sci
355
(1395): 357-60.
PMID
10794054
.
doi
:
10.1098/rstb.2000.0573
.
- ↑
Stavnezer, J., Amemiya, C. T. (2004). ≪Evolution of isotype switching≫.
Semin. Immunol.
16
(4): 257-75.
PMID
15522624
.
doi
:
10.1016/j.smim.2004.08.005
.
- ↑
Durandy, A. (2003). ≪Activation-induced cytidine deaminase: a dual role in class-switch recombination and somatic hypermutation≫.
Eur. J. Immunol.
33
(8): 2069-73.
PMID
12884279
.
doi
:
10.1002/eji.200324133
.
- ↑
Casali P, Zan H (2004). ≪Class switching and Myc translocation: how does DNA break?≫.
Nat. Immunol.
5
(11): 1101-3.
PMID
15496946
.
doi
:
10.1038/ni1104-1101
.
- ↑
Lieber, M. R., Yu, K., Raghavan, S. C. (2006). ≪Roles of nonhomologous DNA end joining, V(D)J recombination, and class switch recombination in chromosomal translocations≫.
DNA Repair (Amst.)
5
(9-10): 1234-45.
PMID
16793349
.
doi
:
10.1016/j.dnarep.2006.05.013
.
- ↑
Weill, J. C. y otros: (1989). ≪Somatic hyperconversion diversifies the single V
H
gene of the chicken with a high incidence in the D region≫.
Cell
59
.
- ↑
Knight, KL: (1992). ≪Restricted V
H
gene usage and generation of antibody diversity in rabbit.≫.
annu. Rev. immunol.
10
.
- ↑
Litman, G.; Cannon, J. P. y Dishaw, L. J. (noviembre de 2005). ≪Reconstructing immune phylogeny:new perspectives≫.
Nature
5
.
- ↑
Bateman, A.; Eddy, S. R. y Chothia, C. (1996).
≪Members of the immunoglobulin superfamily in bacteria≫
.
Protein Science
5
(5).
PMID 8880921
.
- ↑
Dersch, P., Isberg, R. R. (2000).
≪An immunoglobulin superfamily-like domain unique to the Yersinia pseudotuberculosis invasin protein is required for stimulation of bacterial uptake via integrin receptors.≫
.
Infect Immun
68
(5).
PMID 10768991
.
- ↑
Matsunaga, J.; Ko, A. I. y colaboradores: (2005).
≪Pathogenic Leptospira species express surface-exposed proteins belonging to the bacterial immunoglobulin superfamily≫
.
Mol Microbiol
49
(4).
PMCID PMC1237129
.
- ↑
Bateman, A., Eddy, S. R., Mesyanzhinov, V. V. (1997). ≪A member of the immunoglobulin superfamily in bacteriophage T4≫.
Virus Genes
14
(2).
PMID 9237357
.
- ↑
Wojciechowicz, D., Lu, C. F., Kurjan, J., Lipke, P. N. (1993).
≪Cell surface anchorage and ligand-binding domains of the Saccharomyces cerevisiae cell adhesion protein alpha-agglutinin, a member of the immunoglobulin superfamily≫
.
Mol Cell Biol
13
(4).
PMID 8455628
.
- ↑
Grigorescu A, Chen MH, Zhao H, Kahn PC, Lipke PN (2000). ≪A CD2-based model of yeast alpha-agglutinin elucidates solution properties and binding characteristics≫.
IUBMB Life
50
(2).
PMID 11185954
.
- ↑
Nick Matzke (28 de abril).
≪Postulated intermediates in the molecular evolution of the Ig and TCR loci≫
.
Journal of Experimental Medicine
. Consultado el 22 de agosto de 2008
.
- ↑
Muller, C. I., Blumbach, B., Krasko, A., Schroder, H. C. (2001). ≪Receptor protein-tyrosine phosphatases: origin of domains (catalytic domain, Ig-related domain, fibronectin type III module) based on the sequence of the sponge Geodia cydonium≫.
Gene
262
(1-2).
PMID 11179687
.
- ↑
Kubrycht, J., Borecky, J., Soucek, P., Jezek, P. (2004). ≪Sequence similarities of protein kinase substrates and inhibitors with immunoglobulins and model immunoglobulin homologue: cell adhesion molecule from the living fossil sponge Geodia cydonium. Mapping of coherent database similarities and implications for evolution of CDR1 and hypermutation≫.
Folia Microbiol
(49).
3
PMID 15259763
.
- ↑
Brummendorf, T. y Lemmon, V. (2001). ≪Immunoglobulin superfamily receptors: cis-interactions, intracellular adapters and alternative splicing regulate adhesion≫.
Current opinion in cell biology
13
(5).
doi 10.1016/S0955-0674(00)00259-3
.
- ↑
Strecker, G y otros: (2004). ≪Molecular recognition between glyconectins as an adhesion self-assembly pathway to multicellularity≫.
J Biol Chem.
279
(15).
PMID 14701844
.
- ↑
≪The Evolution of Adaptative Immune Systems≫.
Cell
(124). 2006.
DOI 10.1016/j.cell.2006.02.001
.
- ↑
Litman, GW y otros: (2006).
≪Genomic Insights into the Immune System of the Sea Urchin≫
.
Science
314
(5801).
DOI 10.1126/science.1134301
.
- ↑
Noverr, M. C. y Huffnagle, G. B. ≪Does the microbiota regulate immune responses outside the gut?≫.
Trends Microbiol
12
.
PMID
.
- ↑
Oren, M., Douek, J., Fishelson, Z., Rinkevich, B. (2007). ≪Identification of immune-relevant genes in histoincompatible rejecting colonies of the tunicate Botryllus schlosseri≫.
Dev Comp Immunol
31
(9).
PMID 17287019
.
- ↑
Pancer, Z., Diehl-Seifert, B., Rinkevich, B., Muller, W. E. (1997). ≪A novel tunicate (Botryllus schlosseri) putative C-type lectin features an immunoglobulin domain≫.
DNA Cell Biol.
16
(6).
PMID 9212174
.
- ↑
Kapitonov, V. V.; Jurka, J. (2005). ≪RAG1 core and V(D)J recombination signal sequences were derived from Transib transposons≫.
PLoS Biol.
3
.
- ↑
Cannon JP, Haire RN, Litman GW: (2002). ≪Identification of diversified genes that contain immunoglobulin-like variable regions in a protochordate≫.
Nat Immunol
3
(12).
PMID 12415263
.
- ↑
Hernandez Prada JA, Haire RN, Allaire M, Jakoncic J, Stojanoff V, Cannon JP, Litman GW, Ostrov DA: (2006). ≪Ancient evolutionary origin of diversified variable regions demonstrated by crystal structures of an immune-type receptor in amphioxus≫.
Nature
immunology
7
(8).
PMID
.
- ↑
Litman GW, Cannon JP, Dishaw LJ, Haire RN, Eason DD, Yoder JA, Prada JH, Ostrov DA: (2007). ≪Immunoglobulin variable regions in molecules exhibiting characteristics of innate and adaptive immune receptors≫.
Immunol Res.
38
(1-3).
PMID 17917037
.
- ↑
Cooper, M. D. y Alder, M. N. (2006). ≪The Evolution of Adaptive Immune Systems≫.
Cell
124
.
DOI 10.1016/j.cell.2006.02.001
.
- ↑
Janvier, P. (1999). ≪Catching the first fish≫.
Nature
402
.
PMID
.
- ↑
Stein Tore Solem and Jørgen Stenvik.
Antibody repertoire development in teleosts--a review with emphasis on salmonids and Gadus morhua L
. Developmental & Comparative Immunology, Volume 30, Issues 1-2, Antibody repertoire development, 2006, Pages 57-76.
- ↑
Hansen, J. D., E. D. Landis y R. B. Phillips. ≪Discovery of a unique Ig heavy-chain isotype (IgT) in rainbow trout: Implications for a distinctive B cell developmental pathway in teleost fish.≫
Proceedings of the National Academy of Sciences U S A
. Volume 102, Issue 19, 2005, pp. 6919-24.
- ↑
Danilova, N., J. Bussmann, K. Jekosch, L. A. Steiner.
The immunoglobulin heavy-chain locus in zebrafish: identification and expression of a previously unknown isotype, immunoglobulin Z.
Nature Immunology, Volume 6, Issue 3, 2005, pages 295-302.
- ↑
Dooley, H. y M. F. Flajnik. ≪Antibody repertoire development in cartilaginous fish.≫
Developmental & Comparative Immunology
, Volume 30, Issues 1-2, Antibody repertoire development, 2006, pp. 43-56.
- ↑
Padlan, Eduardo (February de 1994).
≪Anatomy of the antibody molecule≫
.
Mol. Immunol.
31
(3): 169-217.
PMID
8114766
.
doi
:
10.1016/0161-5890(94)90001-9
.
- ↑
≪New Sculpture Portraying Human Antibody as Protective Angel Installed on Scripps Florida Campus≫
.
Archivado
desde el original el 18 de noviembre de 2010
. Consultado el 12 de diciembre de 2008
.
- ↑
≪Protein sculpture inspired by Vitruvian Man≫
.
Archivado
desde el original el 18 de noviembre de 2010
. Consultado el 12 de diciembre de 2008
.
- ↑
≪Animated depictions of how antibodies are used in ELISA assays≫
.
Cellular Technology Ltd.?Europe
. Archivado desde
el original
el 9 de mayo de 2007
. Consultado el 8 de mayo de 2007
.
- ↑
≪Animated depictions of how antibodies are used in ELISPOT assays≫
.
Cellular Technology Ltd.?Europe
. Archivado desde
el original
el 18 de noviembre de 2010
. Consultado el 8 de mayo de 2007
.
- ↑
Stern, P. (2006).
≪Current possibilities of turbidimetry and nephelometry≫
.
Klin Biochem Metab
14
(3): 146-151. Archivado desde
el original
el 26 de septiembre de 2007.
- ↑
a
b
Dean, Laura (2005).
≪Chapter 4: Hemolytic disease of the newborn≫
.
Blood Groups and Red Cell Antigens
. NCBI Bethesda (MD): National Library of Medicine (US),.
- ↑
Feldmann M, Maini R (2001). ≪Anti-TNF alpha therapy of rheumatoid arthritis: what have we learned?≫.
Annu Rev Immunol
19
: 163-96.
PMID
11244034
.
doi
:
10.1146/annurev.immunol.19.1.163
.
- ↑
Doggrell S (2003). ≪Is natalizumab a breakthrough in the treatment of multiple sclerosis?≫.
Expert Opin Pharmacother
4
(6): 999-1001.
PMID
12783595
.
doi
:
10.1517/14656566.4.6.999
.
- ↑
Krueger, G., Langley, R., Leonardi, C., Yeilding, N., Guzzo, C., Wang, Y., Dooley, L., Lebwohl, M. (2007). ≪A human interleukin-12/23 monoclonal antibody for the treatment of psoriasis≫.
N Engl J Med
356
(6): 580-92.
PMID
17287478
.
doi
:
10.1056/NEJMoa062382
.
- ↑
Plosker, G., Figgitt, D. (2003). ≪Rituximab: a review of its use in non-Hodgkin's lymphoma and chronic lymphocytic leukaemia≫.
Drugs
63
(8): 803-43.
PMID
12662126
.
doi
:
10.2165/00003495-200363080-00005
.
- ↑
Vogel, C., Cobleigh, M., Tripathy, D., Gutheil,, J., Harris, L., Fehrenbacher, L., Slamon, D., Murphy, M., Novotny, W., Burchmore, M., Shak, S., Stewart, S. (2001). ≪First-line Herceptin monotherapy in metastatic breast cancer≫.
Oncology
. 61 Suppl 2: 37-42.
PMID
11694786
.
doi
:
10.1159/000055400
.
- ↑
LeBien, T. W. (2000).
≪Fates of human B-cell precursors≫
.
Blood
96
(1): 9-23.
PMID
10891425
. Archivado desde
el original
el 18 de noviembre de 2010
. Consultado el 8 de julio de 2008
.
- ↑
Ghaffer, A. (26 de marzo de 2006).
≪Immunization≫
.
Immunology - Chapter 14
. University of South Carolina School of Medicine. Archivado desde
el original
el 27 de junio de 2007
. Consultado el 6 de junio de 2007
.
- ↑
a
b
Fung Kee Fun,g K., Eason E., Crane, J., Armson, A., De La Ronde, S., Farine, D., Keenan-Lindsay, L., Leduc, L., Reid, G., Aerde, J., Wilson, R., Davies, G., Desilets, V., Summers, A., Wyatt, P., Young, D. (2003). ≪Prevention of Rh alloimmunization≫.
J Obstet Gynaecol Can
25
(9): 765-73.
PMID
12970812
.
- ↑
Urbaniak, S., Greiss, M. (2000). ≪RhD haemolytic disease of the fetus and the newborn≫.
Blood Rev
14
(1): 44-61.
PMID
10805260
.
doi
:
10.1054/blre.1999.0123
.
- ↑
a
b
Brehm-Stecher, B., Johnson, E. (2004).
≪Single-cell microbiology: tools, technologies, and applications≫
.
Microbiol Mol Biol Rev
68
(3): 538-59.
PMID
15353569
.
doi
:
10.1128/MMBR.68.3.538-559.2004
.
- ↑
Williams N (2000). ≪Immunoprecipitation procedures≫.
Methods Cell Biol
62
: 449-53.
PMID
10503210
.
doi
:
10.1016/S0091-679X(08)61549-6
.
- ↑
Kurien, B., Scofield, R. (2006). ≪Western blotting≫.
Methods
38
(4): 283-93.
PMID
16483794
.
doi
:
10.1016/j.ymeth.2005.11.007
.
- ↑
Scanziani, E. ≪Immunohistochemical staining of fixed tissues≫.
Methods Mol Biol
104
: 133-40.
PMID
9711649
.
- ↑
Reen, D. J. (1994). ≪Enzyme-linked immunosorbent assay (ELISA)≫.
Methods Mol Biol.
32
: 461-6.
PMID
7951745
.
- ↑
Kalyuzhny, A. E. (2005). ≪Chemistry and biology of the ELISPOT assay≫.
Methods Mol Biol.
302
: 15-31.
PMID
15937343
.
- ↑
Tini, M., Jewell, U. R., Camenisch, G., Chilov, D., Gassmann, M. (2002). ≪Generation and application of chicken egg-yolk antibodies≫.
Comp. Biochem. Physiol., Part a Mol. Integr. Physiol.
131
(3): 569-74.
PMID
11867282
.
- ↑
Cole, S. P., Campling, B. G., Atlaw, T., Kozbor, D., Roder, J. C. (1984). ≪Human monoclonal antibodies≫.
Mol. Cell. Biochem.
62
(2): 109-20.
PMID
6087121
.
- ↑
Kabir, S. (2002). ≪Immunoglobulin purification by affinity chromatography using protein A mimetic ligands prepared by combinatorial chemical synthesis≫.
Immunol Invest
31
(3-4): 263-78.
PMID
12472184
.
doi
:
10.1081/IMM-120016245
.
- ↑
Lennard, S. (2001).
≪Standard Protocols for the Construction of scFv Libraries≫
.
Springer protocols
.
DOI 10.1385/1-59259-240-6:059
.
- ↑
Altria, K. D. (1996).
Capillary Electrophoresis Guidebook Principles, Operation, and Applications, pagina 226
. Humana Press.
ISBN
1-59259-538-3
.
- ↑
Blackburn, G. M. y colaboradores: (1996).
≪Toward antibody-directed "abzyme" prodrug therapy, ADAPT: carbamate prodrug activation by a catalytic antibody and its in vitro application to human tumor cell killing≫
.
PNAS
93
(2). Archivado desde
el original
el 16 de octubre de 2019
. Consultado el 19 de agosto de 2008
.
- ↑
Kobayashi, Shiro; Helmut Ritter, David Kaplan (2006).
Enzyme-Catalyzed Synthesis of Polymers, pag. 206
. Birkhauser.
ISBN
3-540-29212-8
.
- ↑
Hamers-Casterman, C., Atarhouch, T., Muyldermans, S., Robinson, G., Hamers, C., Songa, E. B., Bendahman, N., Hamers, R., ≪Naturally occurring antibodies devoid of light chains.≫
Nature
. 1993 Jun 3;363(6428):446-8
- ↑
≪Nanobodies herald a new era in cancer therapy≫
.
Medical News
. mayo de 2004.
- ↑
Cano, A. A.
≪ANTICUERPOS TERAPEUTICOS: EL CASO DE LOS ANTIVENENOS≫
. Sociedad Mexicana de Bioquimica. Archivado desde
el original
el 3 de diciembre de 2008
. Consultado el 25 de agosto de 2008
.
Bibliografia
[
editar
]
- Janeway, C. A.; Staff, V. V. Traduccion de Eva Sanz (2003).
Inmunobiologia: el sistema inmunitario en condiciones de salud y enfermedad
. Elsevier Espana.
ISBN
978-84-458-1176-4
.
- Pena Martinez, J. (Coordinador) (1998).
Inmunologia
. Piramide.
ISBN
84-368-1213-1
.
Disponible una version en linea en
http://www.uco.es
Enlaces externos
[
editar
]
Nota sobre licencia
: Algunos de los contenidos del presente articulo han sido traducidos o modificados de
Antikorper
,
antibody
y
anticorps
de las wikipedias
alemana
,
inglesa
y
francesa
respectivamente, todas ellas bajo licencia
GFDL
.