Oxido de nitrogeno(I)
|
|---|

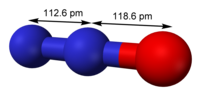
Representacion molecular del oxido hiponitroso.
 |
 |
| Nombre IUPAC
|
|---|
|
Monoxido de dinitrogeno
|
| General
|
|---|
| Otros nombres
|
Oxido de nitrogeno(I)
Oxido hiponitroso
Gas hilarante
Gas de la risa
Protoxido de nitrogeno
Anhidrido hiponitroso
Nitro
E-942
Azo-oxido
|
|---|
| Formula estructural
|
Ver imagen
|
|---|
| Formula molecular
|
N
2
O
|
|---|
| Identificadores
|
|---|
| Numero CAS
|
10024-97-2
[
1
]
|
|---|
| Numero RTECS
|
QX1350000
|
|---|
| ChEBI
|
17045
|
|---|
| ChEMBL
|
CHEMBL1234579
|
|---|
| ChemSpider
|
923
|
|---|
| DrugBank
|
DB06690
|
|---|
| PubChem
|
948
|
|---|
| UNII
|
K50XQU1029
|
|---|
| KEGG
|
C00887 D00102, C00887
|
|---|
|
|
| Propiedades fisicas
|
|---|
| Apariencia
|
Gas incoloro
|
|---|
| Densidad
|
1,2228
kg
/
m³
; 0,0012228
g
/
cm³
|
|---|
| Masa molar
|
4401
g
/
mol
|
|---|
| Punto de fusion
|
182,29 K (?91 °C)
|
|---|
| Punto de ebullicion
|
184,67 K (?88 °C)
|
|---|
| Temperatura critica
|
309,6 K (36 °C)
|
|---|
| Presion critica
|
71,503
atm
|
|---|
| Propiedades quimicas
|
|---|
| Solubilidad
en
agua
|
0,112
g
en 100 g de
agua
|
|---|
| Termoquimica
|
|---|
| Δ
f
H
0
gas
|
82,05 k
J
/
mol
|
|---|
| S
0
gas, 1 bar
|
219,96 J·mol
?1
·
K
|
|---|
| Peligrosidad
|
|---|
| NFPA 704
|
|
|---|
| Riesgos
|
|---|
| Inhalacion
|
Puede causar asfixia.
|
|---|
| Piel
|
Peligroso comprimido o criogenico.
|
|---|
| Ojos
|
Peligroso comprimido o criogenico.
|
|---|
| Compuestos relacionados
|
|---|
| Oxidos de nitrogeno
relacionados
|
Oxido de nitrogeno(II)
,
oxido de nitrogeno(IV)
,
oxido de nitrogeno(VI)
,
tetroxido de dinitrogeno
,
oxido de nitrogeno(V)
|
|---|
| Acidos
relacionados
|
Acido hiponitroso
,
Acido nitroso
,
acido nitrico
|
|---|
Valores en el
SI
y en
condiciones estandar
(25
℃
y 1
atm
), salvo que se indique lo contrario.
|
|
El
oxido de nitrogeno(I)
,
monoxido de dinitrogeno
,
oxido hiponitroso
,
protoxido de nitrogeno
o
anhidrido hiponitroso
, tambien conocido como
gas hilarante
o
gas de la risa
(
N
2
O
), es un gas incoloro con un olor dulce y ligeramente toxico, con efecto anestesico y disociativo.
[
2
]
No es inflamable ni explosivo, pero soporta la combustion tan activamente como el oxigeno cuando esta presente en concentraciones apropiadas con anestesicos o material inflamable. Al ser el tercer gas de efecto invernadero de larga duracion mas importante, el oxido nitroso contribuye sustancialmente al
calentamiento global
y es una sustancia que agota sustancialmente el ozono estratosferico.
[
3
]
Sintesis
[
editar
]
El oxido de nitrogeno(I) se genera convenientemente por la
termolisis
controlada del
nitrato de amonio
o por reaccion de
amoniaco
con
acido nitrico
. Hay que controlar bien las condiciones de esta reaccion porque existe el peligro de explosion. El oxido de nitrogeno(I) se forma tambien en condiciones anaerobicas a partir de abonos minerales en el suelo. Es un gas que contribuye al efecto invernadero y tiene una permanencia media de 100 anos en la atmosfera. Actualmente se atribuye el 5 % del efecto invernadero artificial a este gas. Ademas ataca la capa de
ozono
, reduciendo el ozono a
oxigeno
molecular y liberando dos moleculas de
monoxido de nitrogeno
.
Historia
[
editar
]
A finales del siglo
XVIII
,
Humphry Davy
habia leido el Tratado elemental de Lavoisier y eso lo condujo a practicar la quimica durante toda su vida. A los 19 anos, en 1799 realizo muchos autoexperimentos, peligrosos, para estudiar el comportamiento de los gases tras inhalarlos. Esto en busqueda de tratamientos nuevos, en especial para la tuberculosis. Davy fallo, y casi murio, tras experimentar con el monoxido de carbono.
[
4
]
En 1778,
Thomas Beddoes
fundo un "Instituto Neumatico", y anos mas tarde contrato a Davy, de 19 anos, para que lo ayudara. De esta manera siguio experimentando el efecto de los gases en su propio cuerpo. Anos antes, ya se habia logrado la reaccion para obtener oxido nitroso: 2NO + H2O + Fe → N2O + Fe(OH)2. El monoxido de dinitrogeno se pensaba que era letal y se conocia que explotaba a altas temperaturas. Davy queria comprobar sus propiedades, asi que calento
nitrato de amonio
, recogio el gas que soltaba en fuelles hidraulicos y lo paso por agua para purificarlo. Tras poner el gas en bolsas verdes de seda engrasadas y luego inhalarlo mientras un asistente de laboratorio le tomaba el pulso: Davy sintio un hormigueo placentero, en especial en su pecho y extremidades.
[
4
]
Despues de administrar el mismo gas, las personas empezaron a sentir un hormigueo en cada dedo, ademas de un nuevo placer desconocido en la lengua.
[
5
]
El monoxido de dinitrogeno fue el primer indicio de que los sentimientos profundos del corazon y el cerebro podrian ser susceptibles a la quimica. Davy aumento la dosis, se encerro en la caja de gas y recibio el monoxido de dinitrogeno cuarto por cuarto hasta alcanzar los ocho cuartos, ademas de otros 20 a traves de la boquilla.
[
6
]
De esta manera observo el efecto analgesico del oxido nitroso y escribio sobre el mismo y su potencial para ser utilizado para operaciones quirurgicas en su libro “Investigaciones Quimicas y Filosoficas, principalmente sobre el monoxido de dinitrogeno” ?aunque pasaron 44 anos antes de que los medicos intentaran usarlo para anestesia.
[
4
]
[
6
]
Usos en automovilismo
[
editar
]
Hoy en dia este gas es utilizado en automoviles convencionales modificados. La cadena molecular del gas se rompe durante la combustion en la camara, a unos 275 °C de temperatura, produciendo un aumento del oxigeno (sobrealimentacion) disponible para la combustion con el consecuente aumento de potencia. Asi mismo, el nitrogeno liberado presente en la camara actua como un amortiguador termico tras el aumento de energia liberada. Las caracteristicas en la entrega de potencia de los equipos de oxido nitroso limitan su uso en vehiculos de serie a aumentos de potencia que normalmente no superan los 100 caballos y que mas bien rondan entre los 50 y 75 caballos. Para el uso de mayores potencias se han disenado sistemas progresivos de inyeccion del gas en cuestion, permitiendo asi una rampa de aumento de potencia que evite las sobrecargas por shock en el conjunto motriz y la transmision. Ademas para altas potencias es necesario la modificacion de diversos componentes del motor. No se puede utilizar en cualquier automovil sin antes modificar ciertas piezas.
El uso de equipos de oxido nitroso en vehiculos de serie requiere una variacion en la puesta a punto del avance de encendido, siendo necesario un atraso del mismo. Tambien se recomienda el uso de bujias con un grado termico mayor ("bujias frias"), lo cual asegura una mejor extraccion del exceso de calor en la camara para asi evitar la
detonacion
. Es necesario recordar que, debido al aumento de
comburente
en la camara durante la inyeccion del gas, se necesita un aumento tambien del
combustible
inyectado hacia la camara, para asi mantener una
relacion aire/combustible
adecuada.
Existen 3 tipos de sistemas de oxido nitroso: sistema de inyeccion humeda, sistema en seco y sistema de puerto directo. El sistema en seco esta basado en inyectar el nitro a traves de los inyectores de combustible. En cambio, el sistema humedo tiene un carburador con valvulas de tipo mariposa y anade el nitro al combustible en el mismo lugar y a la misma vez. El sistema de puerto directo es el mas potente de todos ya que introduce el nitro y el combustible directamente en cada puerto de entrada del motor, este sistema generalmente anade el combustible y el oxido de nitroso a una manguera tipo Fogger, la encargada de mezclar ambos compuestos en cada cilindro del motor.
Farmacocinetica
[
editar
]
El oxido nitroso es muy insoluble en sangre y otros tejidos, proveyendo de una induccion rapida de la
anestesia
y a la vez, rapida recuperacion despues de suspender el suministro. Es casi completamente eliminado por los pulmones, con una minima difusion a traves de la piel. No se biotransforma. Este gas quizas sea desintegrado por la interaccion con la
vitamina B12
, presente en las
bacterias intestinales
. Esto resulta en una disminucion en la sintesis de
metionina
, originando signos de deficiencia de vitamina B12 (
anemia megaloblastica
,
neuropatia periferica
) al utilizar oxido nitroso a largo plazo. Por esa razon no se utiliza como analgesico a largo plazo o como sedante en situaciones de
cuidado intensivo
. El oxido nitroso se ha convertido en una droga recreativa moderadamente popular en algunos paises.
[
7
]
Calentamiento global
[
editar
]
El oxido nitroso es un poderoso
gas de efecto invernadero
, por lo que a las emisiones de este gas se las responsabiliza parcialmente junto con el
dioxido de carbono
, el
metano
y algunos aerosoles, de provocar el
calentamiento global
.
[
8
]
Datos adicionales
[
editar
]
- Presion de vapor: 5150 kPa a 20 °C
- Solubilidad en agua: 1,305 l/l agua a 0 °C; 0,596 l/l agua a 25 °C
- Concentracion maxima permitida en lugares de trabajo: 100 ppm
Referencias
[
editar
]
- ↑
Numero CAS
- ↑
[1]
Datos de seguridad del oxido de nitrogeno(I) I.
- ↑
Thompson, R.L., Lassaletta, L., Patra, P.K. et al. Acceleration of global N2O emissions seen from two decades of atmospheric inversion. Nat. Clim. Chang. (2019) doi:10.1038/s41558-019-0613-7
- ↑
a
b
c
La divertida historia del descubrimiento del gas de la risa. BBC News Mundo [Internet]. el 30 de diciembre de 2017 [citado el 12 de mayo de 2020]; Disponible en:
https://www.bbc.com/mundo/noticias-42502691
- ↑
Rourke S. 12 descubrimientos accidentales clave en medicina [Internet]. Medscape. 2017 [citado el 12 de mayo de 2020]. p. 3. Disponible en:
https://espanol.medscape.com/features/diapositivas/59000065#page=3
- ↑
a
b
Davy H. Researches, Chemical and Philosophical, Chiefly Concerning Nitrous Oxide, Or Dephlogisticated Nitrous Air, and Its Respiration. [Internet]. London: J. Johnson; 1800. Disponible en:
https://books.google.com.ec/books?id=7IfOIIksmjwC
- ↑
van Amsterdam, Jan; Nabben, Ton; van den Brink, Wim (2015-12).
≪Recreational nitrous oxide use: Prevalence and risks≫
.
Regulatory toxicology and pharmacology: RTP
73
(3): 790-796.
ISSN
1096-0295
.
PMID
26496821
.
doi
:
10.1016/j.yrtph.2015.10.017
. Consultado el 26 de enero de 2021
.
- ↑
Thompson, R. L.; Lassaletta, L.; Patra, P. K.; Wilson, C.; Wells, K. C.; Gressent, A.; Koffi, E. N.; Chipperfield, M. P.
et al.
(18 de noviembre de 2019).
≪Acceleration of global N 2 O emissions seen from two decades of atmospheric inversion≫
.
Nature Climate Change
(en ingles)
9
(12): 993-998.
ISSN
1758-6798
.
doi
:
10.1038/s41558-019-0613-7
. Consultado el 27 de noviembre de 2019
.
Enlaces externos
[
editar
]