Aminotransferasen
oder
Transaminasen
sind
Enzyme
in allen Lebewesen, welche die Ubertragung von α-
Aminogruppen
von einem
Donor- auf ein Akzeptormolekul
katalysieren
(
Transaminierung
).
Bei einer medizinischen Laboruntersuchung auf Transaminasen handelt es sich um die Messung der
Blutwerte
fur die
Aspartat-Aminotransferase (ASAT)
und die
Alanin-Aminotransferase (ALAT)
, die diagnostische Bedeutung bei
Lebererkrankungen
haben
(
Transaminasenanstieg
)
.
Transaminasen sind unentbehrlich im
Aminosaurestoffwechsel
und bei der
Hexosamin-Biosynthese
. Außerdem ist eine
Glutamat-1-semialdehyd-Aminotransferase
bei
Bakterien
und
Archaeen
an der
Porphyrin
-Biosynthese beteiligt. Transaminasen werden durch
Transaminaseinhibitoren
gehemmt.
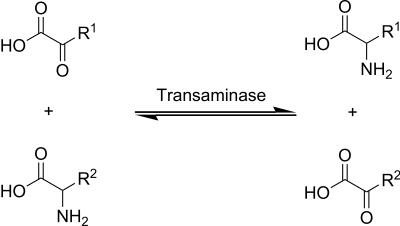
Ublicherweise handelt es sich bei dem Donor um eine
Aminosaure
und bei dem Akzeptor um eine α-
Ketosaure
, wobei aus der Aminosaure eine neue α-Ketosaure und aus der ursprunglichen α-Ketosaure eine neue Aminosaure wird. Als Cofaktor ist in vielen Fallen
Pyridoxalphosphat
beteiligt.
Transaminasen gibt es fur 19 der 20 proteinogenen Aminosauren, wodurch diese eigentlich nur bedingt essenziell sind. Sie konnen aus speziellen Ketosauren konvertiert werden, von denen einige ihrerseits vom Stoffwechsel jedoch nicht bereitgestellt werden. Die Partneraminosaure ist dabei meist
Glutamat
, das zu α-
Ketoglutarat
desaminiert wird und so als universeller Spender fur Aminogruppen dient.
Daher wird Glutamat in der Benennung der Transaminase meist weggelassen.
- Ulf Dettmer, Malte Folkerts, Eva Kachler, Andreas Sonnichsen: Intensivkurs Biochemie (Elsevier-Verlag, Munchen, 1. Auflage 2005,
ISBN 978-3437444500
)
- Smith DM, Thomas NR, Gani D:
A comparison of pyridoxal 5'-phosphate dependent decarboxylase and transaminase enzymes at a molecular level
. In:
Experientia
. 47. Jahrgang,
Nr.
11?12
, Dezember 1991,
S.
1104?18
,
PMID 1765122
.
- Rossi F, Schwarcz R, Rizzi M:
Curiosity to kill the KAT (kynurenine aminotransferase): structural insights into brain kynurenic acid synthesis
. In:
Curr. Opin. Struct. Biol.
18. Jahrgang,
Nr.
6
, Dezember 2008,
S.
748?55
,
doi
:
10.1016/j.sbi.2008.09.009
,
PMID 18950711
.
- Yonaha K, Nishie M, Aibara S:
The primary structure of omega-amino acid:pyruvate aminotransferase
. In:
J. Biol. Chem.
267. Jahrgang,
Nr.
18
, Juni 1992,
S.
12506?10
,
PMID 1618757
.