Dieser Artikel oder nachfolgende Abschnitt ist nicht hinreichend mit
Belegen
(beispielsweise
Einzelnachweisen
) ausgestattet. Angaben ohne ausreichenden Beleg konnten demnachst entfernt werden. Bitte hilf Wikipedia, indem du die Angaben recherchierst und
gute Belege einfugst.
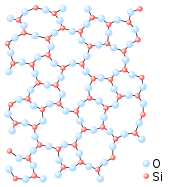 Amorphe Struktur von
Quarzglas
(SiO
2
)
Amorphe Struktur von
Quarzglas
(SiO
2
)
Als
amorphes Material
(
altgriechisch
μορφ?
morphe
?Gestalt, Form“ mit vorgesetztem
Alpha privativum
a-, Sinn also etwa ?ohne Gestalt“) bezeichnet man in
Physik
und
Chemie
einen
Stoff
, bei dem die Bausteine (Elemente oder Molekule) keine sich periodisch wiederholenden Strukturen (
Fernordnung
) aufweisen. Dadurch unterscheiden sich amorphe Materialien von Materialien mit einer
Kristallstruktur
. Insbesondere sind Stoffe im
Glaszustand
amorphe Materialien, aber auch Materialien, die aus Bausteinen mit vielen uneinheitlichen Eigenschaften bestehen.
Aufgrund der fehlenden Fernordnung sind amorphe Materialien ebenso wie Flussigkeiten
makroskopisch
isotrop
, besitzen also keine bevorzugten Raumrichtungen.
Amorphes Material ist haufig instabil bzw.
metastabil
, da es sich nicht im thermodynamisch stabilstem Zustand befindet. Das trifft insbesondere auf
unterkuhlte Flussigkeiten
zu, die unter bestimmten Bedingungen auskristallisieren konnen.
Amorphe Stoffe befinden sich aus Sicht der
physikalischen Chemie
im flussigen Aggregatzustand. Amorph sind oft Stoffe, die aus großen Makromolekulen bestehen, die bereits in der Schmelze (bei hoher Temperatur) eine hohe
Viskositat
aufweisen und bei Abkuhlung schließlich so unbeweglich werden, dass sie sich nicht mehr als Kristall anordnen konnen.
Der
wechselseitige Ubergang
zwischen dem in praktischer Sicht als ?fest und glasartig“ (sehr hohe
Viskositat
und niedrige
Duktilitat
) und dem konventionell als ?flussig“ (geringere Viskositat und hohere Duktilitat) angesehenen Zustand bei Temperaturanderung erfolgt kontinuierlich. Auch andere physikalische Eigenschaften andern sich bei diesem Vorgang nicht sprunghaft, sondern kontinuierlich;
[1]
meist allerdings nicht linear, siehe
Glasubergang
. Beim Schmelzen und Erstarren findet also kein
Phasenubergang
statt und es lasst sich keine
Schmelztemperatur
ermitteln.
Einige amorphe
Metalle
werden auch als metallische
Glaser
bezeichnet. Diese konnen eine außergewohnliche Festigkeit aufweisen und zugleich hochelastisch sein.
Die klassische Methode, um den amorphen Zustand zu erzeugen, ist das ?schnelle“ Abkuhlen einer
Schmelze
oder Flussigkeit. Bedingung fur den amorphen Zustand ist, dass sich die Atome bzw. Molekule beim Abkuhlen nicht regelmaßig anordnen konnen, das heißt, die
Viskositat
muss einen gewissen Wert uberschreiten und es darf nicht zur
Kristallisation
kommen. Die kritische Abkuhlrate, die notig ist, um eine Kristallisation zu vermeiden, hangt vom Material ab. Klassische Glaser wie
Fensterglas
konnen auch relativ langsam (z. B. 1
K
je Minute) abgekuhlt werden. Die meisten amorphen Metalle benotigen dagegen eine Abkuhlrate uber 1000
K
je Sekunde.
Eine verwandte Methode ist das
Aufdampfen
auf ein Substrat durch
chemische
oder
physikalische Gasphasenabscheidung
. Auch dabei kuhlt die Materie zu schnell ab, um sich nach dem Auftreffen auf das Substrat in eine geordnete Struktur zu bewegen.
Ein anderer Weg ist die Herstellung durch Zerstoren der kristallinen Ordnung durch eine starke mechanische Verformung (z. B. in der
Kugelmuhle
), Beschuss durch Ionen oder eine starke Bestrahlung.
Nicht jedes Material lasst sich in amorpher Form herstellen.
Dichten amorpher und kristalliner Materialien
| Material
|
Dichte kristallin
|
Dichte amorph
|
| Silizium
|
2,329 g cm
?3
|
2,285 g cm
?3
|
| Eis
|
0,917 g cm
?3
|
0,94 g cm
?3
(LDA)
[2]
|
| 1,06 g cm
?3
(MDA)
[3]
|
| 1,17 g cm
?3
(HDA)
[4]
|
| 1,26 g cm
?3
(VHDA)
[5]
|
Da die Atome eine geringe
Packungsdichte
aufweisen, hat der amorphe Stoff fast immer eine geringere
Dichte
als der gleiche Stoff in kristalliner Form.
[6]
Beispielsweise hat
amorphes Silicium
eine um etwa 2 % geringere Dichte als kristallines
Silicium
.
[7]
Abweichend davon bildet bspw.
amorphes Eis
Phasen mit einer zwischen 3 % und 34 % hoheren Dichte als der von kristallinem Eis.
[2]
[4]
[3]
[5]
Der amorphe Zustand ist normalerweise metastabil. Beim Erhitzen eines amorphen Stoffes kann es zur spontanen Kristallisation und damit zur Umwandlung in einen stabileren Zustand kommen. Falls es nicht vorher zu Kristallisation kommt, gibt es einen direkten Ubergang in die flussige Phase, ohne einen klassischen
Phasenubergang
.
Glas
ist ein typisches amorphes Material.
Quarzglas
ist die amorphe Form von
Siliziumdioxid
(SiO
2
). Eine seiner kristallinen Formen heißt
Quarz
.
Amorphe Metalle
werden mit Hilfe der Rascherstarrungstechnik in Form von dunnen Folien industriell hergestellt. Hauptanwendungsgebiet sind hierbei
Magnetwerkstoffe
, weichmagnetische
Legierungen
(Fe, Ni, Co) und
amorphe Lotfolie
.
Amorphes Silicium
ist eine nichtkristalline Form des reinen Halbleiters Silicium und wird hauptsachlich fur Dunnschicht-
Solarzellen
verwendet.
Amorpher Kohlenstoff
wird durch Verfahren der
chemischen Gasphasenabscheidung
gewonnen.
Obsidian
ist ein naturliches amorphes Material vulkanischen Ursprungs.
Amorphe
Thermoplaste
(Kunststoffe) sind beispielsweise
Polystyrol
(PS),
Polyvinylchlorid
(PVC) oder
Polycarbonat
(PC). Viele Kunststoffe sind jedoch
teilkristallin
.
Auch
Honig
kann in einem amorphen, kristallinen oder teilkristallinen Zustand vorliegen. Je nach Sorte und Bearbeitung kristallisiert er nach Erwarmung innerhalb weniger Tage oder Wochen wieder teilweise aus und bildet ein Kristallgitter.
- Werner Schatt, Hartmut Worch:
Werkstoffwissenschaft.
Wiley-VCH Verlag, Weinheim 2003,
ISBN 3-527-30535-1
.
- ↑
Glaszustand.
In:
Spektrum.
Abgerufen am 14. April 2024
.
- ↑
a
b
O. Mishima, L.D. Calvert, E. Whalley:
An apparently first-order transition between two amorphous phases of ice induced by pressure.
In:
Nature
.
Band
314
, 1985,
S.
76?78
.
- ↑
a
b
C. G. Salzmann et al.:
Medium-density amorphous ice
. In:
Science
.
Band
379
,
Nr.
6631
, 2. Februar 2023,
S.
474?478
,
doi
:
10.1126/science.abq2105
,
PMID 36730416
,
bibcode
:
2023Sci...379..474R
(
ucl.ac.uk
[PDF]).
- ↑
a
b
P. Gyan, A. Hallbrucker, E. Mayer:
Two calorimetrically Distinct States of Liquid Water Below 150 Kelvin
. In:
Science
.
Band
273
, 1996,
S.
90?92
.
- ↑
a
b
O.Mishima:
Relationship between melting and amorphization of ice
. In:
Nature
.
Band
384
,
Nr.
6609
, 1996,
S.
546?549
,
doi
:
10.1038/384546a0
,
bibcode
:
1996Natur.384..546M
.
- ↑
Helmut Foll:
Einfuhrung in die Materialwissenschaft I: 9. Amorphe Materialien - 9.1.1 Glaser und Polymere.
Christian-Albrechts-Universitat Kiel
, Oktober 2019,
abgerufen am 20. April 2024
.
- ↑
J.S. Custer, et al.:
Density of amorphous Si
. In:
Applied Physics Letters
.
Band
64
,
Nr.
4
, 24. Januar 1994,
ISSN
0003-6951
,
S.
437?439
,
doi
:
10.1063/1.111121
,
bibcode
:
1994ApPhL..64..437C
.