| Potassi
|
19
K
|
|
|
| Aspecte
|
Gris argentat

Perles de potassi en oli de parafina (la grossa fa 0,5 cm)

Linies espectrals del potassi
|
| Propietats generals
|
| Nom,
simbol
,
nombre
|
Potassi, K, 19
|
| Categoria d'elements
|
Metalls alcalins
|
| Grup
,
periode
,
bloc
|
1
,
4
,
s
|
| Pes atomic estandard
|
39,0983(1)
|
| Configuracio electronica
|
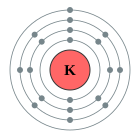
[
Ar
] 4s
1
2, 8, 8, 1
|
| Propietats fisiques
|
| Fase
|
Solid
|
Densitat
(prop de la
t. a.
)
|
0,862 g·cm
?3
|
Densitat del
liquid en el
p. f.
|
0,828 g·cm
?3
|
| Punt de fusio
|
336,53
K
,?63,38 °C
|
| Punt d'ebullicio
|
1.032 K,?759 °C
|
| Punt triple
|
336,35 K
(63 °C)
, kPa
|
| Entalpia de fusio
|
2,33
kJ·mol
?1
|
| Entalpia de vaporitzacio
|
76,9 kJ·mol
?1
|
| Capacitat calorifica molar
|
29,6 J·mol
?1
·K
?1
|
| Propietats atomiques
|
| Estats d'oxidacio
|
1
(oxid
basic
fort)
|
| Electronegativitat
|
0,82 (escala de Pauling)
|
Energies d'ionitzacio
(
mes
)
|
1a: 418,8 kJ·mol
?1
|
| 2a: 3.052 kJ·mol
?1
|
| 3a: 4.420 kJ·mol
?1
|
| Radi atomic
|
227
pm
|
| Radi covalent
|
203±12
pm
|
| Radi de Van der Waals
|
275
pm
|
| Miscel·lania
|
| Estructura cristal·lina
|
Cubica centrada en la cara

|
| Ordenacio magnetica
|
Paramagnetic
|
| Resistivitat electrica
|
(20 °C) 72 nΩ·m
|
| Conductivitat termica
|
102,5 W·m
?1
·K
?1
|
| Dilatacio termica
|
(25 °C) 83,3 μm·m
?1
·K
?1
|
| Velocitat del so
(barra prima)
|
(20 °C) 2.000 m·s
?1
|
| Modul d'elasticitat
|
3,53 GPa
|
| Modul de cisallament
|
1,3 GPa
|
| Modul de compressibilitat
|
3,1 GPa
|
| Duresa de Mohs
|
0,4
|
| Duresa de Brinell
|
0,363 MPa
|
| Nombre CAS
|
7440-09-7
|
| Isotops mes estables
|
| Article principal:
Isotops del potassi
|
|
|
El
potassi
es l'
element quimic
de simbol
K
i
nombre atomic
19. Es un
metall
blanc
argentat
tan tou que es pot tallar amb un ganivet sense dificultat. Te un baix
punt de fusio
i es bon conductor termic i de l'electricitat.
[1]
Es abundant en la natura, per exemple a l'aigua de mar (que conte un 0,04% de potassi en massa
[2]
) o en
minerals
diversos, com l'
ortosa
. S'
oxida
rapidament en l'
aire
, es molt reactiu, especialment en
aigua
, i s'assembla quimicament al
sodi
. Es un
element quimic essencial
per a la vida. Te un rol fonamental en la
propagacio dels impulsos nerviosos
. La principal aplicacio industrial del potassi es el seu us en la fabricacio d'
adobs
. Altres usos aprofiten l'elevada
solubilitat
aquosa dels compostos de potassi, per exemple, per a la fabricacio de sabons.
[3]
Caracteristiques principals
[
modifica
]
Es el segon
metall
mes lleuger; es un solid tou que es talla amb facilitat amb un ganivet,
te un punt de fusio molt baix i crema amb flama violeta. Presenta un color argentat en les superficies exposades a l'aire, ja que s'oxida amb rapidesa, cosa que obliga a emmagatzemar-lo recobert d'oli.
[5]
De la mateixa manera que altres
metalls alcalins
reacciona violentament amb l'
aigua
desprenent
hidrogen
i, fins i tot, pot inflamar-se espontaniament en presencia d'aigua.
Altres sals de potassi importants son el
bromur
,
cianur
,
potassi
,
iodur
, i el
sulfat
.
Paper biologic
[
modifica
]
El
catio
K
+
esta present en els extrems dels
cromosomes
, anomenats
telomers
, estabilitzant-ne l'estructura. Aixi mateix, l'io hexahidratat, igual que el corresponent io de
magnesi
, estabilitza l'estructura de l'
ADN
i de l'
ARN
compensant la carrega negativa dels
grups fosfat
.
La bomba de sodi es un mecanisme pel qual s'aconsegueixen les concentracions requerides d'ions K
+
i Na
+
dins i fora de la cel·lula ?concentracions d'ions K
+
mes altes dins de la cel·lula que en l'exterior? per a possibilitar la transmissio de l'
impuls nervios
.
El descens del nivell de potassi a la
sang
provoca
hipopotassemia
. Les
hortalisses
(
remolatxa
,
coliflor
) i
fruites
(especialment les de pinyol com l'
albercoc
,
cirera
,
pruna
, bresquilla, etc.) son aliments rics en potassi.
Tambe es un element essencial per al creixement de les
plantes
. Es un dels tres que consumeixen en major quantitat, ja que l'io potassi interve en la
fotosintesi
, part important de la
fisiologia
dels vegetals.
El potassi, el nom en catala del qual ve del neollati cientific
potassium
, i aquest del neerlandes
pottasche
, cendra de pot ?nom amb que el va batejar
Humphry Davy
en descobrir-lo el
1807
? va ser el primer element
metal·lic
aillat per
electrolisi
, de l'
hidroxid de potassi
(KOH), compost del nom llati del qual,
Kalium
, prove el
simbol quimic
del potassi
K
.
El mateix Davy feia el seguent relat del seu descobriment davant de la
Royal Society of London
el 19 de novembre de 1807: ≪Vaig col·locar un petit fragment de potassa sobre un disc aillat de plati que comunicava amb el costat negatiu d'una bateria electrica de 250 plaques de coure i zinc en plena activitat. Un fil de plati que comunicava amb el costat positiu fou posat en contacte amb la cara superior de la potassa. Tot l'aparell funcionava a l'aire lliure. En aquestes circumstancies es va manifestar una activitat molt viva; la potassa va comencar a fondre's en els seus dos punts d'electritzacio. Va haver-hi en la cara superior (positiva) una viva efervescencia, determinada pel despreniment d'un fluid elastic; en la cara inferior (negativa) no es desprenia cap fluid elastic, pero van apareixer
petits globuls de viva brillantor metal·lica completament semblants als globuls de mercuri
. Alguns d'aquests globuls, a mesura que es formaven, cremaven amb explosio i flama brillant; altres perdien a poc a poc la seua brillantor i es cobrien finalment d'una crosta blanca. Aquests globuls formaven la substancia que jo buscava; era un principi combustible particular, era
la base de la potassa: el potassi≫.
La importancia del descobriment rau en el fet que va confirmar la hipotesi d'
Antoine L. Lavoisier
: si l'hidroxid de sodi (NaOH) i l'hidroxid de potassi (KOH) reaccionaven amb els acids de la mateixa manera que els oxids de plom i argent era perque estaven formats de la combinacio d'un metall amb l'oxigen; extrem que es va confirmar en aillar el potassi i tan sols una setmana despres el sodi per electrolisi de la sosa. A mes, l'obtencio del potassi va permetre el descobriment d'altres elements, ja que donada la seva gran reactivitat es capac de descompondre oxids en robar-los l'oxigen; d'aquesta manera van poder aillar-se el
silici
, el
bor
i l'
alumini
.
Abundancia i obtencio
[
modifica
]
El potassi constitueix de l'orde del 2,4% en pes de l'
escorca terrestre
, cosa que en fa el sete element mes abundant. Donada la seva
insolubilitat
es molt dificil obtenir el metall pur a partir dels seus
minerals
. Tot i aixo, en antics llits marins i de llacs existeixen grans diposits de minerals de potassi (
carnal·lita
,
langbeinita
,
polihalita
i
silvita
) en els que l'extraccio del metall i les seves sals es economicament viable.
La principal mena de potassi es la
potassa
que s'extrau a
California
,
Alemanya
,
Nou Mexic
,
Utah
i altres llocs. A
Saskatchewan
hi ha grans diposits de potassa a 900 m de profunditat, que en el futur poden convertir-se en fonts importants de potassi i sals de potassi.
Els oceans tambe poden ser proveidors de potassi, pero en un volum qualsevol d'aigua salada la quantitat de potassi present es molt menor que la de sodi, quedant minvat el rendiment economic de l'operacio.
Gay-Lussac
i
Louis J. Thenard
van utilitzar el 1808 un metode consistent a fondre la potassa i fer-la travessar ferro escalfat al blanc per a obtenir el potassi, metode que es va emprar fins a 1823, any en que
Brunner
va obtenir el metall escalfant a alta temperatura una mescla de carbonat potassic i carbo. Ambdos metodes tenien un rendiment molt deficient, fins que
Sainte-Claire Deville
va descobrir que el metode de Brunner podia ser millorat utilitzant
carbonat de calci
en la mescla. A l'actualitat el metall s'obte per
electrolisi
del seu
hidroxid
en un proces que ha patit tan sols petites modificacions des de l'epoca de Davy.
 Potassi en
feldespat
Potassi en
feldespat
Es coneixen disset isotops de potassi, tres d'ells naturals K-39 (93,3%), K-40 (0,01%) i K-41 (6,7%); el K-40, amb un
periode de semidesintegracio
d'1,25
E
9 anys, decau a
Ar-40
(11,2%) i
Ca
-40 (88,8%).
La desintegracio del K-40 en Ar-40 s'empra com a metode per a la
datacio
de roques. El metode K-Ar convencional es basa en la hipotesi que les roques no contenien argo quan es van formar i que el format no va escapar d'elles, sino que va ser retingut de manera que el present prove completament i exclusivament de la desintegracio del potassi original. El mesurament de la quantitat de potassi i Ar-40 i aplicacio d'aquest procediment de datacio es adequat per a determinar l'edat de
minerals
com el
feldespat
volcanic,
moscovita
,
biotita
i
hornblenda
i en general les mostres de roques volcaniques i intrusives que no han patit alteracio.
Mes enlla de la datacio, els isotops de potassi s'han utilitzat molt en estudis del
clima
, aixi com en estudis sobre el cicle dels nutrients per ser un macronutrient requerit per a la vida.
L'isotop K-40 esta present en el calci natural en quantitat suficient perque els sacs de compostos de potassi comercial puguin emprar-se en les demostracions escolars com a font radioactiva.
El potassi solid reacciona violentament amb l'aigua, mes fins i tot que el
sodi
, aixi que s'ha de conservar immers en un liquid apropiat com
oli
o
querose
.
Bibliografia
[
modifica
]
- Mans i Teixido
, C.
≪
Per que hi ha tants metalls a la taula periodica?
≫.
L'Atzavara
, 30, 2020, pag. 27-31.
DOI
:
10.2436/20.1502.atz30.027
.
- Diccionario Enciclopedico hispanoamericano, Tom XVI
, Barcelona, Montaner i Simon Editors, 1895.
- Greenwood
, Norman N.;
Earnshaw
, Alan.
Chemistry of the Elements
. 2a edicio. Butterworth-Heinemann, 1997.
ISBN 978-0-08-037941-8
.
Enllacos externs
[
modifica
]
Viccionari